LINK-NAME
Was ist Leben? Wie ist Leben entstanden? Wie hat sich Leben entwickelt? Diese Fragen sind alt, es werden immer wieder neue Antworten gefunden, aber wirklich beantwortet sind sie noch nicht. Hier soll ein Aspekt besonders betrachtet werden, dessen Bedeutung für die Entstehung und erste Entwicklung des Lebens und der Lebewesen auf der Erde erst in den letzten Jahrzehnten allgemein anerkannt wurde, die Symbiose.
Die Einteilung der Lebewesen
Die Vielfalt der Lebewesen wurde traditionell in „Pflanzen“ und „Tiere“ eingeteilt. Schon LINNÉ verteilte alle Lebewesen auf diese beiden „Reiche“. In der makroskopischen Welt fällt es uns im allgemeinen auch nicht schwer, ein Lebewesen als Pflanze oder Tier zu erkennen. Auch nachdem man mit Hilfe von Mikroskopen die Welt der Mikroorganismen immer besser kennenlernte, behielt man lange Zeit diese Einteilung bei. So wurden Einzeller zu den Tieren gerechnet, wenn sie kein Chlorophyll enthielten und keinen Kohlenstoff assimilieren konnten. Zu den Pflanzen rechnete man die Einzeller mit Chloroplasten. Manche, wie etwa die „Augentierchen“ (Euglena), brachten sowohl Zoologen als auch Botaniker in ihren Systemen unter.
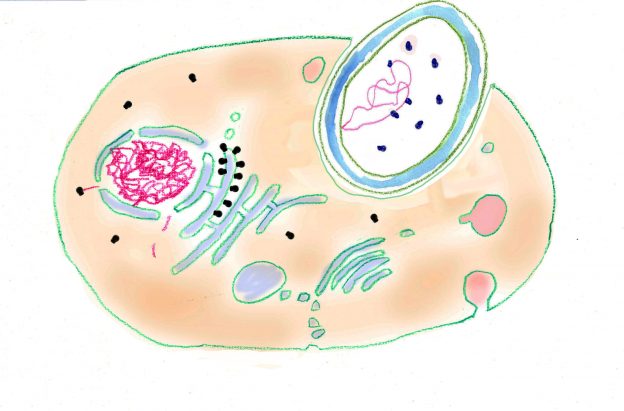
Aber in der ersten Hälfte des 20. Jahrhunderts wurde immer deutlicher, dass der grundlegendste Unterschied zwischen den Lebewesen nicht „Tier“ oder „Pflanze“ sondern die Organisation der einzelnen Zellen ist. Bei den „Kernlosen“ sind die Zellen wesentlich einfacher gebaut. Sie enthalten keinen Zellkern und es fehlen ihnen viele typische Zellorganelle. Bei den „Kernhaltigen“ sind außer den Zellkernen auch noch andere typische Zellorganelle, insbesondere Mitochondrien, Plastiden, Zentriolen, Geißeln usw., in den Zellen enthalten und sie sind durch ein komplexes inneres Membransystem kompartimentiert. Die für diese unterschiedlichen Organisationstypen eingeführten Begriffe „Prokaryoten“ und „Eukaryoten“ gehen auf den französischen Mikrobenforscher Edouard Chatton zurück, der die Namen in einer Veröffentlichung von 1937 verwendete (Katscher 2004). Doch erst 25 Jahre später gewannen diese Bezeichnungen auf Grund einer Arbeit von Stanier und van Niel (1962) allgemeine Akzeptanz und wurden auch in Lehrbüchern übernommen.
In den 1970 er Jahren untersuchte der amerikanische Mikrobiologe Carl Woese die Verwandtschaftsbeziehungen innerhalb der Bakterien durch Vergleich der ribosomalen RNA. Dabei fand er heraus, dass es zwei grundlegend unterschiedliche Typen von Prokaryoten gibt, die er zunächst als Bakterien und Archaebakterien bezeichnete. Aufgrund der großen Unterschiede zwischen diesen beiden Gruppen und der teilweisen Ähnlichkeit der Archaebakterien mit den Eukaryoten schlugen er und andere (Woese, Kandler, Wheelis 1990) später vor, eine Dreiteilung der Lebewesen in die drei Domänen Archaea, Bacteria und Eukarya vorzunehmen. Dieses Drei-Domänen-Konzept setzte sich allmählich durch, obwohl es auch starke Gegner gab, zum Beispiel den Evolutionsbiologen Ernst Mayr (1998) und die Wiederentdeckerin der Endosymbiontentheorie Lynn Margulis (1998).
Aus Tiefsee-Geothermalquellen wurden 2010 Sedimente entnommen, in denen man in den folgenden Jahren Archäen nachweisen konnte, die sich deutlich von den bisher bekannten Archäen unterscheiden. Vergleichende Untersuchungen der Genome von Lokiarchaeum und von Eukaryoten deuten auf einen gemeinsamen phylogenetischen Ursprung, eine Monophylie, hin. Das würde bedeuten, dass die Eukarya eine Schwestergruppe der Lokiarchaeota innerhalb der Archaea, sind, dass es also aus kladistischer Sicht nur zwei Domänen Bacteria und Archaea gibt (Spring et al. 2015; Zaremba-Niedwiedzka et al. 2017).
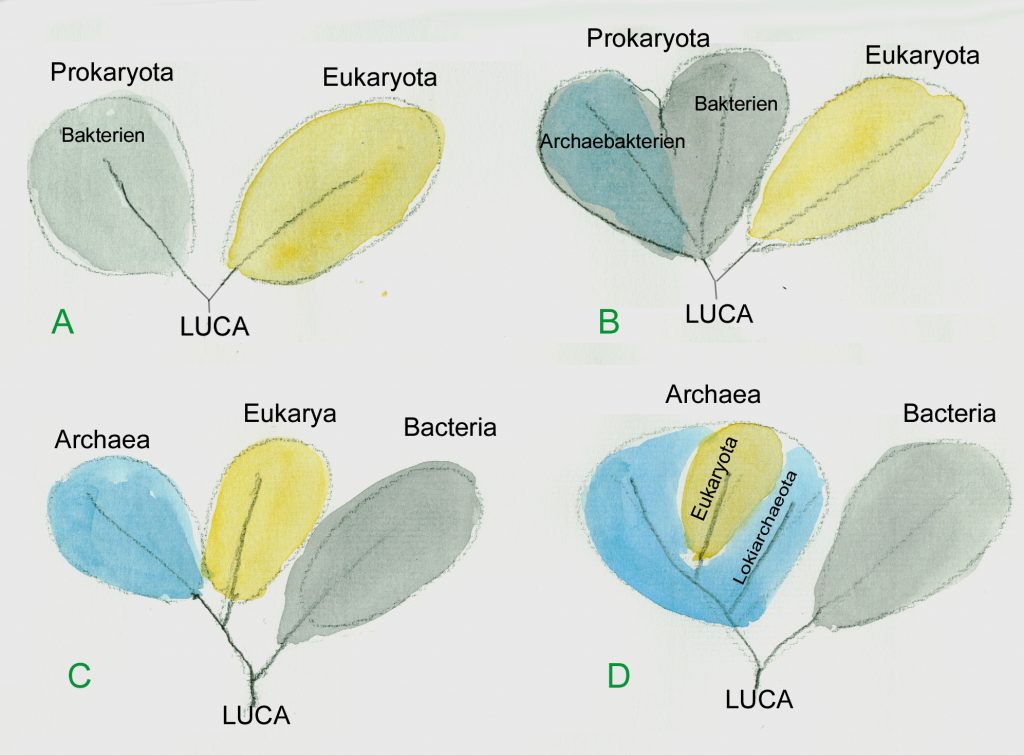
Einteilung der Lebewesen. A, nach Zellen ohne Kern und Zellen mit Kern; B die Kernlosen bestehen aus zwei sehr unterschiedlichen Gruppen; C drei Domänen; D die Kernhaltigen sind Teil der Archäen (Grafik W.Probst)
Urzelle oder Ursuppe?
Allen Lebewesen gemeinsam sind eine Zellstruktur, DNA, der genetische Code sowie mRNA, tRNA und eine durch Ribosomen vermittelte Übersetzung (Translation) des Nukleinsäurecodes in Proteine. Dies spricht dafür, dass alle Lebewesen von einem gemeinsamen Vorfahr abstammen (last universal common ancestor LUCA). Wenn sich alle heute lebenden Arten auf eine Ursprungsart zurückführen lassen, könnte man Rückschlüsse auf die Eigenschaften dieses Urahnen ziehen, wenn man in den Genomen Nukleinsäurenabschnitte finden würde, die allen heutigen Lebewesen gemeinsam sind. Eine Analyse von 6,1 Mill. Protein-codierender Gene von sequenzierten prokaryotischen Genomen hat zu der Schlussfolgerung geführt, dass LUCA ein anaerober, CO2– und N2-fixierender, H2-abhängiger thermophiler Prokaryot war und danach an einer an CO2, H2 und Eisen reichen Hydrothermalquelle lebte (Weiss et al. 2016). Diese Ergebnisse sind jedoch nicht ganz unumstritten, da nicht immer eindutig geklärt werden kann, welche Gene wirklich ursprünglich sind und welche durch horizontalen Gentransfer später erworben wurden.
Die Bedeutung des horizontalen Gentransfers bzw. des Austauschs und der Aufnahme von Nukleinsäuremolekülen durch frühe, zellulär organisierte Lebewesen könnte so stark gewesen sein, dass die Gene in einem Urzustand des Lebens noch nicht sehr eng an bestimmte zelluläre Lebewesen gekoppelt sondern eher Allgemeingut waren. In einer solchen „Ursuppe“ existierten zelluläre Elemente (Protocyten) neben freien RNA- und DNA-Molekülen (Ribozyme, Viroide) und Virus-ähnlichen Partikeln (Virionen, von Proteinhüllen umgebene Nukleinsäuremoleküle). Zwar wurde lange Zeit angenommen, dass Viren erst entstehen konnten, nachdem es zelluläres Leben gab, da sie auf den Proteinsyntheseapparat von Zellen angewiesen sind. Aber die Entdeckung von Riesenviren (Mimivirus) hat diese Ansicht ins Wanken gebracht. Diese 2003 beschriebenen bakteriengroßen Viren aus Amöben haben zwar auch keine eigenen Ribosomen aber doch ein sehr komplexes Genom, das auch Gene enthält, die man vorher nur von zellulären Organismen kannte (La Scola et al. 2003).
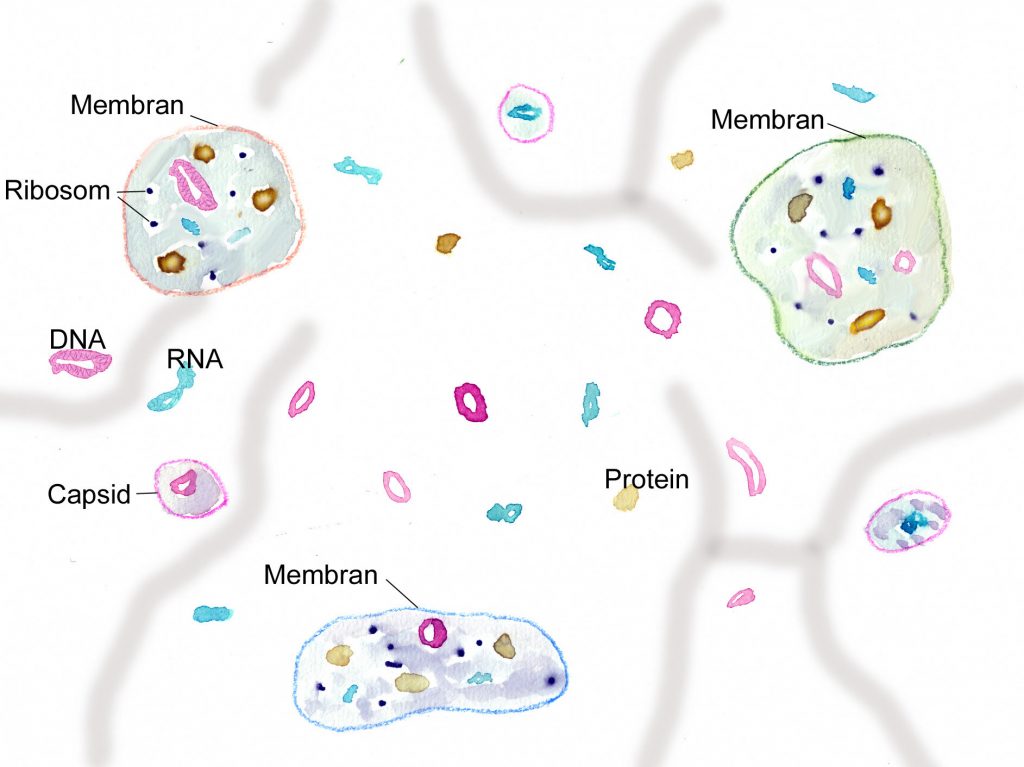
„Ursuppe“ aus zellulären Elementen (Protocyten) neben freien RNA- und DNA-Molekülen (Ribozyme, Viroide) und Virus-ähnlichen Partikeln (Virionen, von Proteinhüllen umgebene Nukleinsäuremoleküle) und Proteinen, strukturiert durch anorganische Kompartimente (Grafik W.Probst)
Ein Austausch und eine Aufnahme von Nukleinsäureabschnitten durch Zellen und Virionen hätte zunächst die Ausbildung spezifischer Zelltypen, die in „darwinschen Wettbewerb“ miteinander treten konnten, verhindert. Der heute noch weitverbreitete horizontale Genaustausch bei Bakterien und Archäen wäre dann ein Relikt dieses Anfangszustandes.
Nach dieser Vorstellung wäre es auch möglich, dass Bakterien und Archäen sich nicht auf eine gemeinsame Protocyte zurückführen lassen, sondern dass ihre Wurzeln auf unterschiedliche Vorläuferzellen der Ur-Lebensgemeinschaft zurückgehen.
LECA und Mitochondrien
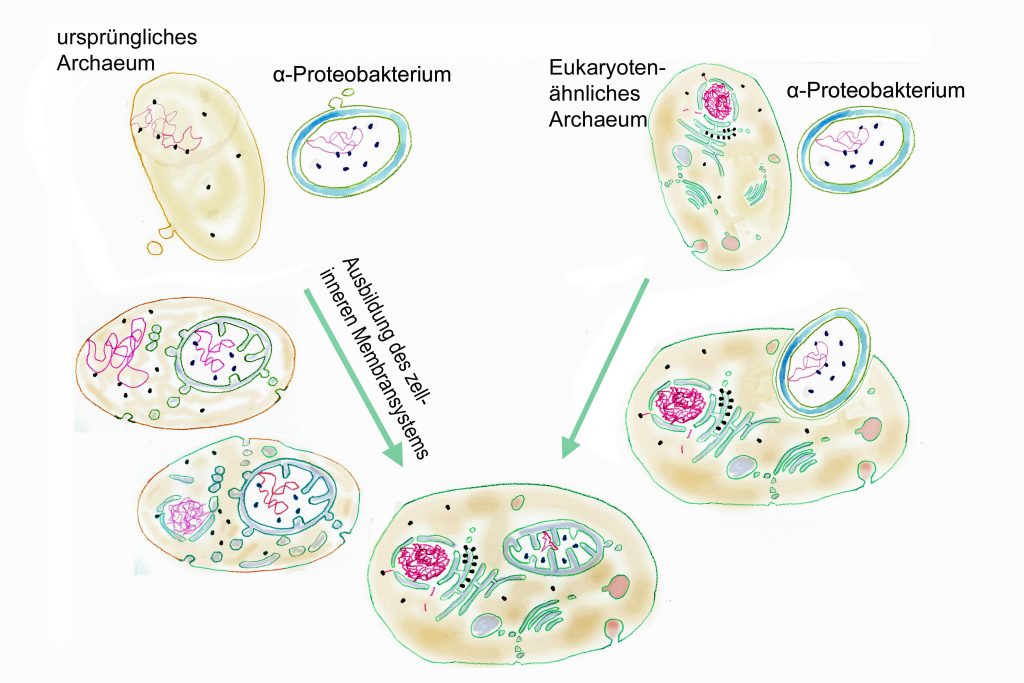
Die meisten neueren Untersuchungen deuten drauf hin, dass die erste eukaryotische Zelle (last eukaryotic common ancestor LECA) durch die Aufnahme eines α-Proteobakteriums durch ein Archaeum, vermutlich aus der Asgard-Gruppe (Eme et al. 2017, Zaremba-Niedzwiedzka et al. 2017), entstanden ist. Für diesen symbiotischen Weg zur ersten eukaryotischen Zelle gibt es zwei unterschiedliche Hypothesen.
Nach der traditionellen Vorstellung haben sich in der Archäenzelle als Voraussetzung für die Aufnahme des Proteobakteriums zunächst ein Großteil der für die Eukaryotenzellen typischen komplizierteren Innenstrukturen entwickelt, insbesondere das Cytoskelett, die Kernmembran und die Fähigkeit zur Phagocytose. Dann wurden α-Proteobakterien zunächst als Nahrung aufgenommen. Einige Bakterien widerstanden der Verdauung und wurden zu Endosymbionten, gut geschützt in der Wirtszelle, die vor allem von dem überschüssigen ATP ihrer Mieter profitierte. Die Endosymbionten gaben ihre Selbstständigkeit immer mehr auf, indem Gene aus ihrem Genom in das Wirtszellengenom verlagert wurden (Endosymbiontischer Gentranfer EGT). So entwickelten sich aus den endosymbiontischen Bakterien allmählich Organelle. Nach dieser Vorstellung betrieben die aufgenommenen α-Proteobakterien bereits eine aerobe Atmungskette, bei der als Endprodukte außer ATP CO2 und H2O gebildet wurden.
Eine Alternative Vorstellung geht davon aus, dass die symbiontische Zusammenarbeit von α-Proteobakterien und Archäen unter anaeroben Verhältnissen begann und dass die Archäen noch keine Eukaryoten-Innenstrukturen hatten. In einer sauerstofffreien Umgebung nutzten methanogene Archäen von zumindest fakultativ anaeroben α-Proteobakterien produziertes CO2 und H2 für die Energiebereitstellung durch Reaktion dieser Ausgangsstoffe zu Methan. Je größer die Berührungsflächen der beiden verschiedenen Prokaryoten-Zellen, desto effektiver konnte der Stoffaustausch sein. Dies führte schließlich dazu, dass das α-Proteobakterium ganz von dem Archaeum umschlossen wurde. Die weitere Entwicklung des Archaeums zur Eucyte und des Endosymbionten zum Mitochondrium verlief parallel.
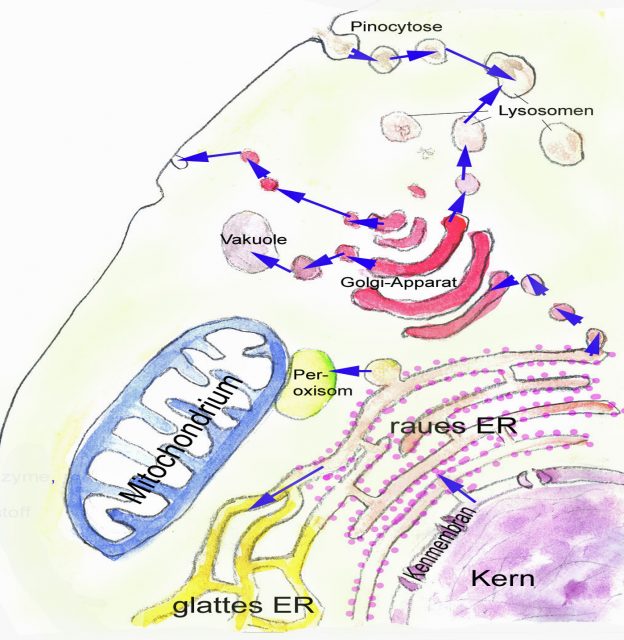
Es spricht vieles dafür, dass sich das intrazelluläre Membransystem einschließlich der Kernmembran dabei vom Endosymbionten ausgehend ausgebildet hat, und zwar durch Abschnürung von Vesikeln von der äußeren Zellmembran des gramnegativen Bakteriums (Gould, Garg, Martin 2016). So entstanden allmählich die verschiedenen membranumschlossenen Kompartimente der Eucyte: die doppelte Kernmembran, das Endoplasmatische Retikulum, der Golgi-Apparat und verschiedene Membranbläschen wie Lysosomen und Peroxisomen. Ein Argument für diesen Weg ist, dass die umhüllende Zellmembran der Eukaryoten, obwohl ursprünglich aus einer Archäenzelle hervorgegangen, in ihrem Aufbau mehr einer Bakterienzellmembran entspricht. Bei Archäen sind die Fettsäuren nicht – wie bei Bakterien oder Eukaryoten – verestert. Sie bilden Glyceroldiether oder sogar Bis-Glycerol-Tetraether (einschichtige Membran, Monolayer) und statt einfacher, unverzweigter Fettsäuren kommen oft verzweigte Ketten vor. Der Austausch dieser Glycerolether gegen Glycerolester könnte dadurch zustande gekommen sein, dass die äußere Zellmembran allmählich durch den Einbau von Membranvesikeln des Endosymbionten umgebaut wurde.
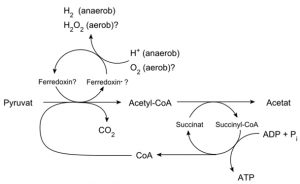
Eine weitere Stütze dieser Entstehungshypothese der Eukaryoten bilden die sogenannten Hydrogenosomen, ATP-bildende Organellen, die in anaerob lebenden Protisten und anderen niederen, in sauerstofffreiem Milieu existierenden Lebewesen vorkommen. Ihre Homologie mit Mitochondrien hat man erst durch Genomanalysen festgestellt. Die meisten Hydrogenosomen enthalten zwar keine DNA, aber in den Kernen der zugehörigen Organismen konnte man Mitochondriengene nachweisen. Anders als bei Mitochondrien dienen bei Hydrogenosomen zur ATP-Bildung nicht Sauerstoffmoleküle sondern Wasserstoffionen (Protonen) als Elektronenakzeptoren. Dabei wird CO2, H2 und Acetat freigesetzt.
Nach der ersten Entstehungshypothese müsste man annehmen, dass sich die Hydrogenosomen durch Reduktion aus aeroben Mitochondrien entwickelt haben. Geht man davon aus, dass es sich um den ursprünglichen Zustand handelt und dass sich die Mitochondrien aus Hydrogenosomen entwickelt haben, wäre dies eine Stütze der zweiten Entstehungshypothese.
Für beide Vorstellungen gilt, dass im Laufe der Endosymbiose immer mehr Gene aus dem α-Protobakterium in das Wirtszellengenom übertragen wurden (EGT). So entstand schließlich das Mitochondrium, ein Zellorganell, das nur noch wenige eigene Gene – bei menschlichen Mitochondrien 37 (Archibald 2014) – und einen stark reduzierten Proteinsynthese-Apparat besitzt. Die meisten Mitochondrien-Proteine werden im Cytosol produziert und über spezielle Membranproteine in die Mitochondrien transportiert.
Plastiden
Auch für die Chloroplasten und alle verwandten, insgesamt als Plastiden bezeichneten Zellorganelle ist heute unbestritten, dass sie durch Endocytosymbiose entstanden sind. Dabei kann man zwischen primärer und sekundärer Endocytosymbiose unterscheiden. Bei der primären Endocytosymbiose wurden Cyanobakterien von eukaryotischen Zellen aufgenommen, bei der sekundären Endocytosymbiose bereits Plastiden enthaltende eukaryotische Zellen. Man kann drei Organismengruppen unterscheiden, deren Plastiden auf primäre Endocytosymbiose zurückzuführen sind:
- die Chlorophyta mit Chloroplasten (Grünalgen einschließlich der grünen Pflanzen)
- die Rhodophyta mit Rhodoplasten (Rotalgen)
- die Glaucophyta mit blaugrünen Plastiden (übersetzt „Blaugraue Algen“, nicht zu verwechseln mit dem alten Begriff „Blaualgen“ für Cyanobakterien; kleine Gruppe einzelliger Algen)
Die Plastiden der Glaucophyta sind den Cyanobakterien noch sehr ähnlich. Sie werden deshalb auch als Cyanellen bezeichnet. Wie die Zellen der Cyanobakterien enthalten sie Phycobilisomen als Photosynthese-Antennen. Zwischen den beiden Zellmembranen existiert noch eine dünne Peptidoglycanschicht, die typische Zellwandsubstanz der Bakterien. Das Genom ist allerdings durch EGT schon sehr stark verkleinert auf etwa ein Zehntel der Größe eines frei lebenden Cyanobakteriums.

Phycobilisom – Lichtsammelkomplex in den Photosynthesemembranen von Cyanobakterien, Glaucophyta und Rhodophyta (W.Probst nach G.Richter aus Kadereit 2014)
Die Plastiden der Rhodophyta enthalten ebenfalls Phycobilisomen als Fotosynthese-Antennen aber keine Peptidoglycanschicht. Charakteristisch sind als zusätzliche Pigmente Phycobiline (offenkettigen Tetrapyrrole) wie Phycocyan und Phycoerythrin, die für die häufig rötliche Färbung der Rotalgen verantwortlich sind.
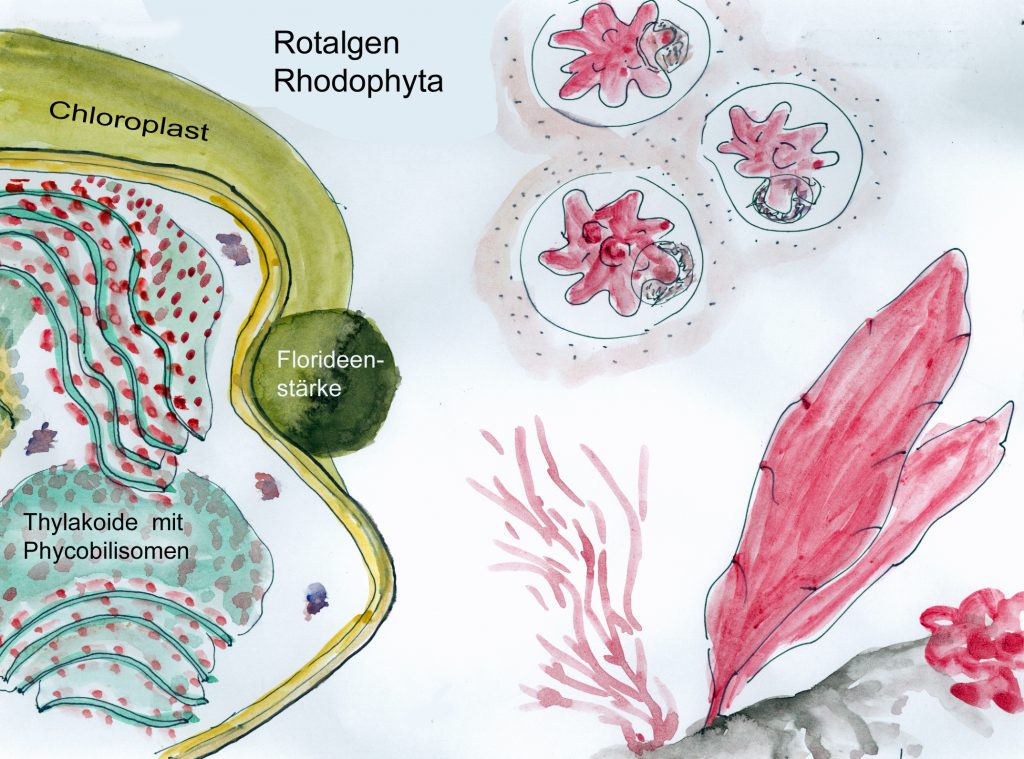
Rhodoplast der Rotalgen mit Phycobilisomen auf den Thylakoiden; rechts einzellige (oben) und vielzellige (unten) Beispiele für Rhodophyta (W. Probst nach versch. Vorlagen)
Die Chlorophyta enthalten Plastiden ohne Phycobilisomen und Peptidoglycanschicht. Charakteristisch für ihre Chloroplasten sind geldrollenartig gestapelte Doppelmembran-Pakete (sogenannte Grana).
Wichtigstes Fotosynthese-Pigment in den Plastiden aller drei Gruppen ist Chlorophyll a. Bei den Chlorophyta kommt außerdem Chlorophyll b vor.
Aufgrund von Fossilfunden und molekulargenetischen Daten vermutet man, dass die endosymbiotische Aufnahme von Cyanobakterien durch eukaryotische, mitochondrienhaltige Einzeller vor etwa 1,5 Milliarden Jahren stattfand (Parfrey, L. W. et al. 2011). Man nimmt an, dass die Cyanobakterien durch Phagocytose als Nahrungspartikel aufgenommen wurden. Dabei werden die aufzunehmenden Nahrungspartikel von einer Phagocytose-Membran umhüllt, in welche Verdauungsenzyme abgegeben werden (Endosomen). Die heutigen Plastiden haben nur die zwei auf die Cyanobakterien zurückgehenden Außenmembranen. Von der „Verdauungsmembran“ der eukaryotischen Zelle ist nichts übrig geblieben.
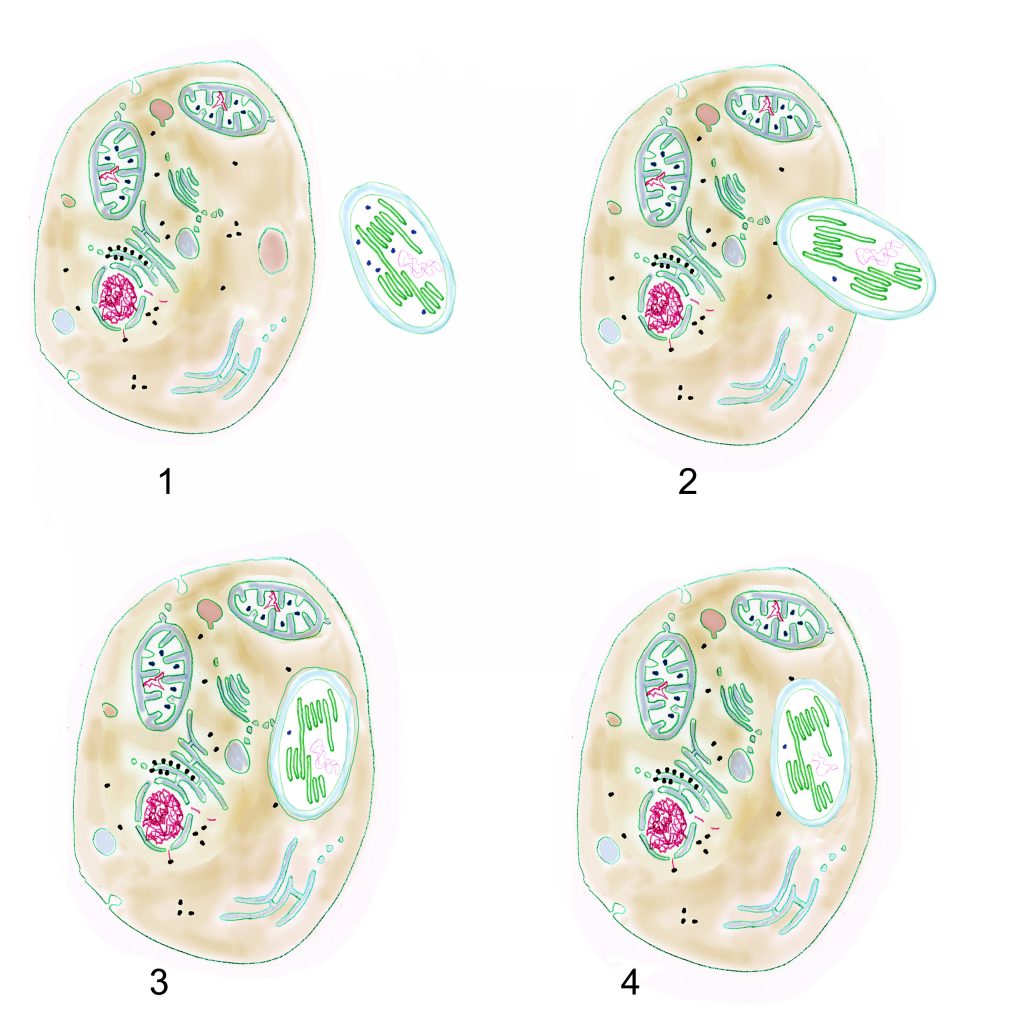
1 eukaryotische Zelle und Cyanobakterium; 2 beginnende Phagocytose; 3 Cyanobakterium in Endosom; 4 auf dem Weg zum Organell: Endosomenmembran verschwunden, Cyanobakterien-DNA durch EGT reduziert (Grafik W. Probst)
Auch bei den Plastiden ist vom ursprünglichen Genom des Cyanobakteriums nur ein Bruchteil im Organell zurückgeblieben. Von 2000-12.000 Genen bei Cyanobakterien sind in Plastiden noch 60-200 nachzuweisen (Archibald 2014 nach Dragan et al. 2013). Umgekehrt findet sich aber eine beachtliche Anzahl von Cyanobakterien-Genen in den Zellkernen der Plastiden-haltigen Eukaryoten. Bei einer Untersuchung der Modell-Landpflanze Acker-Schmalwand konnten Martin et al. (2002) etwa 4500 der 25.000 Gene der Pflanze auf einen cyanobakteriellen Ursprung zurückführen. Dabei muss natürlich berücksichtigt werden, dass bei den Genomen der Pflanzen Verdopplungen von Teilen oder ganzen Genomen eine wichtige Rolle gespielt haben. Dabei wurden auch die von Cyanobakterien stammenden Gene verdoppelt. Überraschend war, dass nur etwa 50 % dieser Gene für Proteine zu codieren scheinen, die mit Funktionen im Chloroplasten zu tun haben. Ähnliche Verhältnisse konnten später auch für andere Plastiden-haltige Eukaryoten festgestellt werden. Daraus lässt sich erkennen dass der Vorgang der Endocytosymbiose und der damit verbundene endosymbiontische Gentransfer (EGT) weit über die Photosynthesefunktion hinausgehende Folgen hatte. Das Ergebnis waren völlig neue Organismen!
Aufgrund der deutlichen Unterschiede der Plastiden von Glaucophyta, Rhodophyta und Chlorophyta liegt die Vermutung nahe, dass ihrer Entstehung drei getrennte Endosymbiosen zugrunde liegen. Durch molekulargenetische Untersuchungen konnte diese ursprüngliche Annahme jedoch nicht bestätigt werden. Die Restgenome aller drei Plastiden-Typen zeigen große Übereinstimmung. Außerdem treten bestimmte für die Chloroplastenmembran-Durchlässigkeit wichtige Proteine, die von den Kernen der Algenzellen gebildet werden, bei allen drei Gruppen auf. Man nimmt deshalb an, dass es einen gemeinsamen Vorfahr gab und dass die Endosymbiose zur Bildung der Chloroplasten nur einmal stattgefunden hat (Archibald 2014 nach Martin et al. 1998, Turner et al. 1999, McFadden,van Dooren 2004). Glaucophyta, Rhodophyta und Chlorophyta werden deshalb in der phylogenetischen Systematik als Monophylum angesehen und als Archaeplastida bezeichnet.
Sekundäre Plastiden

Schönaugengeißler (Euglena viridis) und einer seiner Chloroplasten (W. Probst nach versch. Vorlagen)
„Augentierchen“ (besser Augengeißler, Euglena viridis), einzellige, schnell schwimmende grüne Algen, die man in Tümpeln und Pfützen finden kann, faszinierten schon die ersten Mikroskopiker. Da ihre Chloroplasten Chlorophyll a und b enthalten, wurde lange Zeit angenommen, dass sie zu den Grünalgen (Chlorophyta) gehören. Erst eine gründliche Untersuchung durch die Algenforscherin Sarah Gibbs führte zu der erstaunlichen Erkenntnis, dass die Chloroplasten von Euglena aus einer endosymbiontischen Grünalge hervorgegangen sind (Gibbs 1978), die Augentierchen selbst aber in eine völlig andere Verwandtschaftsgruppe gehören. Anlass für die genaue Untersuchung war, dass die Chloroplasten – wie schon länger bekannt – nicht von zwei sondern von drei Membranen umgeben waren.
Bei verschiedenen anderen Algen kommen sogar Plastiden mit 4 Membranhüllen vor. In solchen von vier Membranen umgebenen Plastiden von Schlundgeißlern (Cryptophyta) wurden zwischen den zwei äußeren und den zwei inneren Membranen Nukleinsäure- haltige Körper entdeckt, die man als Reste von ehemaligen Zellkernen der endosymbiontischen Eukaryoten identifizieren konnte und die man deshalb als „Nucleomorphe“ bezeichnet. Bei der zweiten Endosymbiose kam es – genauso wie bei der ersten – zu einem endosymbiontischen Gentransfer. Bei vielen Algen wie Euglena, Kieselalgen und großen Braunalgen (Tangen) ist der Kernrest der aufgenommenen eukaryotischen Alge vollständig verschwunden, d. h. die Gene wurden vollständig in den Wirtskern integriert, aber an den drei oder vier Hüllmembranen der Plastiden kann man erkennen, dass diese das Ergebnis von zwei Endosymbiosen sind.
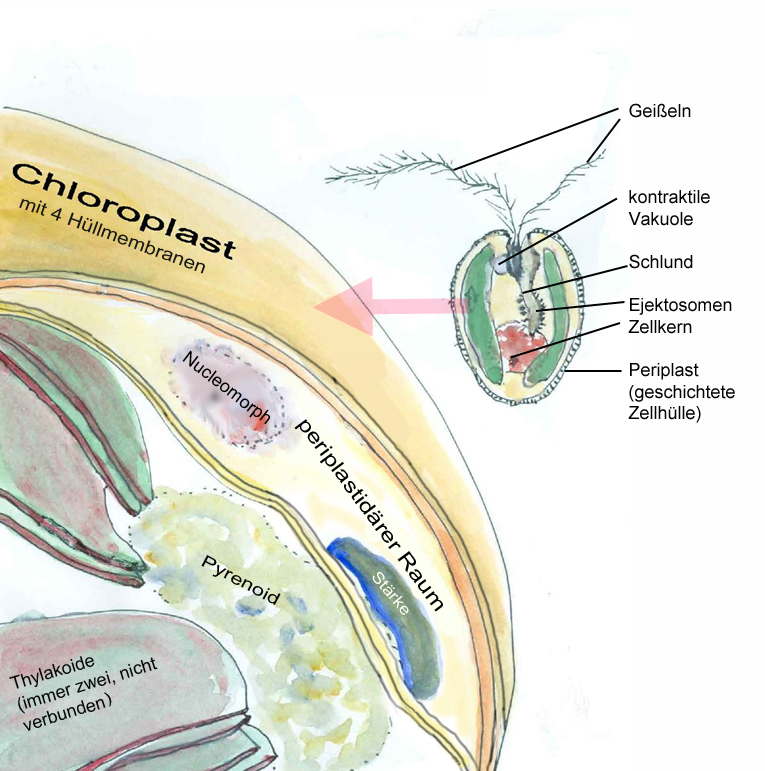
Schlundgeißler (Cryptophyceae) mit 4 Hüllmembranen um seine Plastiden und einem Kernrest (Nucleomorph) zwischen den beiden äußeren und den beiden inneren Membranen (W. Probst nach versch. Vorlagen)
Die Chomatophoren der Schlundgeißler haben sich aus endosymbiontischen Rotalgen entwickelt. Dies gilt auch für andere Algen mit bräunlichen oder gelblichen Chromatophoren aus der Verwandtschaftsgrupp der Heterokontophyta, zum Beispiel für die Kieselalgen, die Goldalgen und die Braunalgen.
Eine weitere Algengruppe mit sekundären Chloroplasten, die auf Grünalgen zurückgehen, sind die Chlorarachniophyta, amöboide Eukaryoten aus der Gruppe der Rhizaria. Ihre Chloroplasten sind ebnfalls von vier Hüllen umgeben und sie enthalten Nukleomorphe. Auch sie wurden früher zu den Grünalgen gerechnet. Sie sind zwar zur Photosynthese fähig, aber wie chlorophyllfreie Amöben ernähren sie sich auch durch Phagocytose von Bakterien und kleinen Einzellern.
Bei Dinoflagellaten kennt man auch tertiäre Endocytobiosen, bei denen eine einzellige Alge aus der Gruppe der Cryptophyta als Endosymbiont aufgenommen wurde.
Auf dem Weg zur Chloroplastenbildung
Die Schalenamöbe Paulinella chromatophora hat eine ellipsoide oder birnenförmige aus spiralig angeordneten Silikatplatten zusammengesetzte Schale. Sie lebt zwischen Wasserpflanzen oder im oberflächlichen Sediment von Süßgewässern. In ihrem Inneren enthält sie zwei wurstförmige blaugrüne Körper, die man zunächst als Chromatophoren bezeichnete. Durch molekulargenetische Analysen konnten sie als Abkömmlinge Blaugrüner Bakterien der Gattungen Synechococcus bzw. Prochlorococcus identifiziert werden. Die Aufnahme dieser Endosymbionten, die mit den Vorfahren der Plastiden nicht näher verwandt sind, liegt bei weitem nicht so lange zurück wie bei den Plastiden. Die Endosymbiose ist zwar schon weit fortgeschritten, sodass weder Paulinella noch ihre Chromatophoren für sich alleine lebensfähig sind. Sie enthalten noch 867 Proteine codierende Gene, was etwa einem Viertel des Genoms von frei lebenden Synechococcus-Arten entspricht. Die Genanalyse des Wirtsgenoms zeigte, dass hier schon Endosymbionten-Gene enthalten sind. Es konnte auch eindeutig nachgewiesen werden, dass vom Kern codierte Proteine in die Chromatophoren transportiert wurden. Man kann sagen, dass diese Endosymbionten bereits auf dem Weg zum Organell sind. Sie werden deshalb von manchen Forschern auch schon als Chloroplasten oder Plastiden bezeichnet. Aufgrund der genetischen Untersuchungen vermutet man, dass die Endosymbiose von Paulinella etwa 100 Millionen Jahre alt ist (Archibald 2014).
Der zu den Glomeromyceten zählende Pilz Geosiphon pyriforme ist anders als die übrigen Vertreter dieser Pilzklasse kein Mykorrhizapilz, aber er enthält endocytosymbiontische Blaugrüne Bakterien der Gattung Nostoc. Bisher kennt man keine andere Pilzart mit endosymbiontischen Cyanobakterien. Der photosynthetisch aktive Symbiosepartner wächst in blasenförmigen Erweiterungen der Pilzhyphen, die etwa 1 x 1,5 mm groß sind. Geosiphon ist ohne seine Endosymbionten nicht lebensfähig, der Endocytosymbiont Nostoc punctiforme kann dagegen auch frei lebend gedeihen. Frei lebende Nostoc-Fäden aus wenigen Zellen werden von den Pilzhyphen in einem bestimmten Entwicklungsstadium des Pilzes über Endocytose aufgenommen. Nach der Aufnahme wachsen die Pilzhyphen zu den makroskopisch erkennbaren Blasen aus, in denen sich die aufgenommenen Nostoczellen vermehren. Außer normalen Zellen bildet Nostoc auch Heterocysten aus, die zur N2-Fixierung in der Lage sind – also eine „Stickstoffsymbiose“ wie bei Hüllsenfrüchtlern und anderen Pflanzen. Der Pilz erhält von den Blaugrünen Bakterien einen Teil des gebildeten Zuckers und des gebundenen Stickstoffs, dafür liefert der Pilz seinem Endosymbionten Wasser, Phosphat und Kohlenstoffdioxid und alle weiteren benötigten anorganischen Stoffe. Außerdem schützt er Nostoc vor Stress durch giftige Schwermetalle. Geosiphon bildet – wie viele Glomeromyceten – auch noch eine Symbiose mit einem Bakterium, über die aber bisher nur wenig bekannt ist. Zum anderen bildet der Pilz enge Gemeinschaften mit Hornmoosen und mit dem Lebermoos Blasia pusilla, die beide ihrerseits mit Nostoc in einer extrazellulären Symbiose leben. Glomeromyceten waren vermutlich als Symbiosepartne für die Besiedelung terrestrischer Lebensräume durch die ersten Pflanzen sehr wichtig, möglichrweise sogar Voraussetzung (Wang et al. 2010). Schüßler (2011) vermutet, dass es sich bei der Endosymbiose von Geosiphon und der Arbusculären Mykorrhiza von den meisten heute bekannten Glomeromyceten um eine parallele Entwicklung mit ähnlichen Austauschvorgäng handelt. Bei Gloeosiphon ist der Photosynthese betreibende Partner (Cyanobakterium) innen, im anderen Fall (Pflanze) außen.
Die Kieselalge Rhopalodia gibba besitzt – wie alle Kieselalgen – sekundäre Plastiden, die auf Rotalgen-Endosymbionten zurückgehen. Außerdem enthalten die Zellen dieses Einzeller aber einen weiteren Endosymbionten, der zunächst als „Sphaeroid“ beschrieben wurde. Man konnte nachweisen, dass es sich dabei um ein endosymbiontisches Cyanobakterium aus der Gattung Cyanothece handelt. Dieser Endosymbiont führt allerdings keine Photosynthese mehr durch, aber er kann molekularen Stickstoff assimilieren. Sein Genom enthält mit 2,6 Millionen Basenpaaren noch etwa die Hälfte einer frei lebenden Cyanobakterienart der Gattung Cyanothece (Archibald 2014). Die genetischen Verhältnisse dieser Kieselalge sind dementsprechend recht kompliziert. Im Zellkern findet man
- Gene der Rotalge, von der der Chloroplast abstammt,
- von dem Cyanobaktium, das zum primaren Chloroplasten der Rotalge wurde und
- von dem Genom des weiteren stickstoffbindenden Cyanobakteriums.
Außerdem enthalten Chloroplast und Cyanobakterienendosymbiont noch eigene Genomreste. Diese verschiedenen Gene und ihre Produkte wirken bei dem effektiven Ablauf des Zellstoffwechsels zusammen.
Pflanzentiere und Kleptoplasten
Alle Photosynthese betreibende Algen und alle grünen Pflanzen verdanken ihre Fähigkeit zur Kohlenstoffassimilation ursprünglich endosymbiontischen Cyanobakterien. Aber darüber hinaus ist es im Laufe der Evolution immer wieder zu einer Kooperation zwischen Kohlenstoff-heterophen und Kohlenstoff-autotrophen Lebewesen gekommen. Die Autotrophie durch Endosymbiose ist eine Fortsetzungsgeschichte.
Schon im 19. Jahrhundert wurden verschiedene Symbiosen von Algen mit Niederen Tieren und Pilzen entdeckt. Karl Brandt (1881 nach Sapp 1994) beschrieb die endosymbiontischen Mikroalgen in Einzellern, Hohltieren, Mollusken und Würmern. Er nannte die grünen Vertreter „Zoochlorellen“ und die gelbbräunlich gefärbten „Zooxanthellen“. Keeble untersuchte und beschrieb 1910 als erster die grünen, darmlosen wurmähnlichen Tiere (Gattung Symsagittifera früher Convoluta) der bretonischen Atlantikküste und nannte sie „plant animals“. Sie werden heute der an der Basis des Tierreiches stehenden Gruppe der Acoelomorpha zugeordnet.
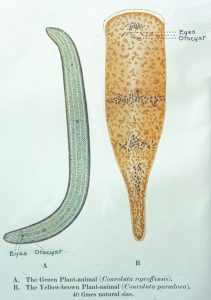
Keebles Zeicchnung der beiden Acoelomorpha Symsagittifera roscoffensis und Convoluta convoluta, früher zuden Strudewürmern gerechnet
Während es sich bei den „Zoochlorellen“ tatsächlich um Grünalgen handelt, allerdings wohl um eine polyphyletische Gruppe, stammen die „Zooxanthellen“ aus ganz unterschiedlichen Verwandtschaftsgruppen der „Protisten“. Sie ähneln sich, weil sie ihre Gestalt als Endosymbionten erheblich vereinfacht haben. Eine besonders verbreitete endosymbiontische Alge gehört zu den Dinoflagellaten (Gattung Symbiodinium), andere werden den Kieselalgen, den Goldalgen und den Haftfadengeißlern zugeordnet. Bei tropischen Foraminiferen und bei Schwämmen konnte man sogar Rotalgen als Endocytobionten nachweisen (Reisser 1992).
Nehmen die Partner nur über die äußere Oberfläche Kontakt auf, so spricht man von Exosymbiose. Ein gutes Beispiel dafür ist die Flechtensymbiose. Kolonisiert der kleinere Partner den größeren, indem er in sein Körperinneres eindringt, so spricht man von Endosymbiose (Acoelomorpher Symsagittifera roscoffensis und Zoochlorelle Tetraselmis convolutae), wenn er sogar in die Zellen des Partners eindringt, von Endocytosymbiose (Paramecium bursaria und Chlorella). Gerade dieser letzte Fall ist bei einzelligen Algen besonders häufig. Verbreitet sind solche Endocytosymbiosen nicht nur bei Einzellern wie Wimpertierchen, Foraminiferen und Wurzelfüßern, sondern auch bei Nesseltieren (einschließlich der Korallen), Niederen Würmern und marinen Schnecken.
Eine besondere Art der „sekundären Kohlenstoffautotrophie“ kennt man von der Schneckenordnung der Schlundsackschnecken (Ordnung Sacoglossa). Diese Gruppe mariner Hinterkiemer ernährt sich vorwiegend von siphonalen Algen, also Fadenalgen, deren Zellfäden nicht durch Querwände unterteilt sind. Die Schnecken stechen die Algen mit einem stilettartig spezialisierten Zahn an. Nach dieser Punktation saugen sie den Zellsaft durch ihren muskulösen Pharynx ein. Auf diese Weise können große Zellsaftmengen durch einen Einstich aufgesaugt werden. Die grüngefärbte Meeresschnecke Elysia chlorotica saugt an der Schlauchalge Vaucheria litorea. Sie verdaut einen Großteil des Zellsaftes und integriert die Plastiden durch Phagocytose in die Epithelzellen ihres Verdauungstraktes. Durch Versuche in Aquarien konnte man feststellen, dass die Schnecken ohne Nahrung nur durch Belichtung 8-9 Monate überleben können. In diesem Zusammenhang hat man von „Chloroplastensymbiose“ gesprochen, besser wäre wohl die Bezeichnung Kleptoplastie (altgriech. kleptein = stehlen), da diese Organelle tatsächlich von den Algen gestohlen oder ausgeborgt worden sind. Zu einem Gentransfer von den Plastiden in die Zellkerne von Schneckenzellen kommt es in diesem Falle allerdings nicht.
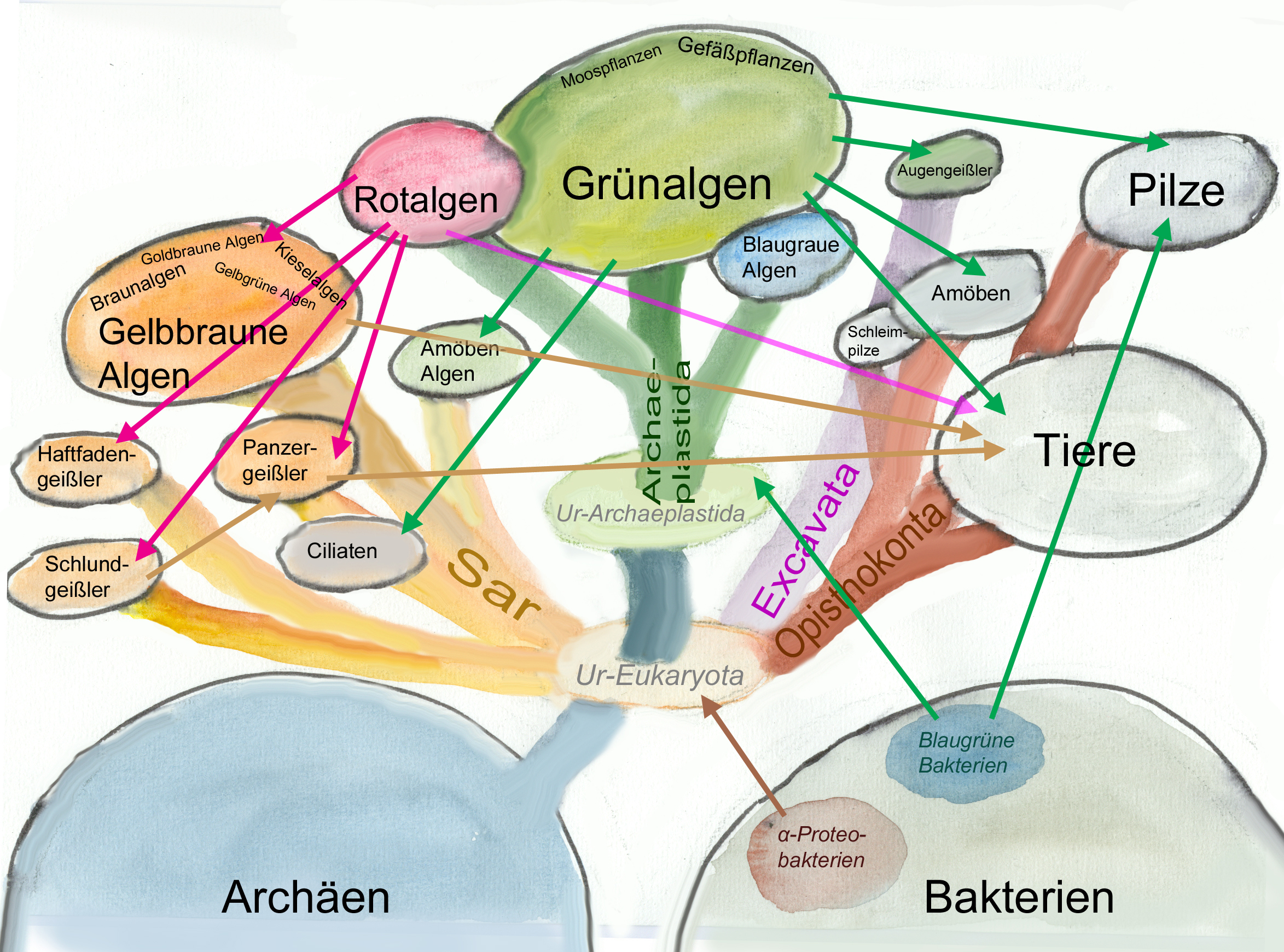
Stammbaum der Photobionten und ihren direkten bzw. indirekten Symbiosen mit Blaugrünen Bakterien. Die breiten farbigen Verbindungsbahnen deuten die Verwandtschaftsbeziehungen der Wirtzellen bzw. -organismen an, die Pfeile zeigen die Herkunft der Plastiden. Nur der unterste braune Pfeil markiert die Endocytosymbiose, die zu den Mitochondrien führte. Die verschiedenen Farben markieren die großen Verwandtschaftsgruppen Sar, Archaeplastida, Excavata und Opisthokonta (Grafik W. Probst).
„Verdauungsendosymbiosen“
Viele von Pflanzensäften lebende Insekten (Wanzen, Zikaden, Blattläuse) kooperieren zur besseren Nahrungsnutzung mit endosymbiontischen Bakterien. Eine besonders enge Symbiose besteht zwischen Blattläusen und den endocytobiontischen Bakterien der Gattung Buchnera, die in speziellen, großen Darmzellen leben, die als Bakteriocyten bezeichnet werden. Die Endosymbionten werden von Generation zu Generation über die Eier weitergegeben. Buchnera ist verwandt mit Escherichia coli, aber im Gegensatz zu diesem weit verbreiteten Darmbakterium ist ihr Genom wesentlich kleiner. Dafür sind in einer Zelle über 100 Kopien enthalten. Eine vollständige Genomanalyse von Buchnera ergab, dass keine Gene für Zelloberflächen-Lipopolysaccharide und Phospholipide vorhanden sind. Ebenso fehlen die meisten Regulatorgene und Gene, die der Verteidigung der Zellen nach außen dienen. Das enge Zusammenleben mit den Wirten wird auch dadurch deutlich, dass von Buchnera alle für seinen Wirt essentiellen Aminosäuren gebildet werden. Dafür sind mindestens 55 Gene verantwortlich. Umgekehrt werden von dem Bakterium keine für den Wirt nicht essentiellen Aminosäuren produziert. Die Blattläuse bilden statt des insektenüblichen stickstoffhaltigen Exkrets Ammoniak Glutamin, das von den Bakterien diekt als Ausgangsstoff für die Produktion der essentiellen Aminosäuren verwendet wird. Diese Komplementarität zeigt, dass die Symbiose schon sehr lange erfolgreich arbeitet. Da Buchnera sogar seine Außenmembran vom Wirt erhält, kann man sagen, dass bei dieser Symbiose ein Stadium erreicht ist, das Buchnera schon fast als ein Zellorganell erscheinen lässt.
Noch komplizierter ist die Doppelendocytobiose in Darmzellen von Motten-Schildläusen (Aleyrodoidea). Durch Genanalysen entdeckte man, dass in den Darmzellen-Bakterien ein weiteres endosymbiontisches Bakterium lebt (McCutcheon, von Dohlen 2011).
Viele ähnliche Beziehungen kommen bei Holz bzw Zellulose fressenden Insekten wie Tabakskäfer, Borkenkäfer und Termiten vor. Auch blutsaugende Egel, Zecken und Läuse bessern die Inhaltsstoffe ihrer relativ einseitigen Nahrung durch symbiontische Darmbakterien auf. Sie können in besonderen Darmzellen, in Darmaussackungen oder auch frei im Darmlumen vorkommen. Aber auch für Säugetiere einschließlich des Menschen ist das Darm-Mikrobiom von großer Bedeutung und erfüllt in vielen Fällen die Definition der mutualistischen Symbiose. Die für die menschliche Ernähung so wichtig Milchproduktion de Rinder ist abhänig von den endosymbiontischen Darmmikroben dieser Herbivoren.
Gibt es Monophylie?
Es wird immer deutlicher, dass Endosymbiosen und auch Endocytosymbiosen im Laufe der Stammesgeschichte der Lebewesen eine große Rolle gespielt haben. Wie erste Untersuchungsergebnisse zeigen, sind dabei viele Gene von den Endosymbionten auf ihre Wirte übertragen worden. Die von der synthetischen Theorie der Evolution verwendete Bezeichnung „Gendrift“ für einen Evolutionsfaktor gewinnt dadurch eine ganz neue Bedeutung. Allerdings handelt es sich bei der hier betrachteten „Gendrift“ nicht um ein zufälliges Ereignis, sondern um die Folge einer auf kooperativen Stoffwechselvorgängen beruhenden engen Kooperation zwischen verschiedenen Organismen. Die moderne phylogenetische Systematik (Kladistik) versucht, das System der Lebewesen aufgrund einer auf genetischen Grundlagen beruhenden Stammbaum-Rekonstruktion aufzustellen. Taxonomische Einheiten sollen eine Monophylum darstellen, d. h., sie sollen sich auf eine Ursprungsart zurückführen lassen, die außer den Vertretern des Taxons keine anderen Nachkommen hat. Diese Methode – so schwierig sie auch im Detail sein mag – ist in sich logisch, solange Gene nur vertikal weitergegeben werden. Sobald es aber häufiger zu einer horizontalen Genweitergabe kommt, entstehen Probleme. Denn nun geht es nicht nur um gemeinsame Nachfahren sondern auch um gemeinsame Vorfahren. Ich komme zurück auf unsere einleitende Betrachtung der Großeinteilung der Lebewesen. Nach neuesten Erkenntnissen sind die Eukaryoten ein Teil der Archäen, allerdings nur, soweit es um die Wirtszelle geht. Die für die Entstehung und Weiterentwicklung sehr wichtigen Mitochondrien und Plastiden kommen aus der Domäne Bakterien. Die Eukaryoten haben also mindestens einen weiteren gemeinsamen Vorfahr im Vergleich zu den übrigen Archäen, soweit es sich um Plastiden-haltige Eukaryoten handelt sogar mindestens zwei weitere. Durch die Kombination ist wirklich etwas Neues entstanden, dem man mit gewissem Recht eine eigene Domäne zuerkennen könnte. Nach kladistischen Taxonomieregeln müsste das aber bedeuten, dass man die im übrigen ziemlich gut definierten Archäen nicht mehr als eine systematische Einheit ansehen könnte, da es sich um kein Monophylum handelt. Die sogenannte Asgardgruppe müsste als eigene, den übrigen Archäen und den Bakterien gleichrangige Einheit angesehen werden. Da die Eukaryoten wahrscheinlich sogar aus der Mitte der Asgardgruppe entstanden sind, wäre unter Umständen eine weitere Aufspaltung notwendig. Ich denke, phylogenetische Taxonomen müssten hier zu Kompromissen finden. Das gilt nicht nur für dieses basale Beispiel, sondern für viele ähnliche Fälle.
Quellen
Archibald, J. (2014): One plus one equals one. Symbiosis and the evolution of complex life. Oxford: Oxford University Press
De Bary (1879): Die Erscheinung der Symbiose. Straßburg: Trübner
Delwiche, C. F. (1999): Tracing the Thread of Plastid Diversity Through the Tapestry of Life. The American Naturalist 154, Supplement: .Evolutionary Relationships Among Eukaryotes, pp 164-177. doi:10.1086/303291
Delwiche, C., F., Cooper, E., D. (2015): The evolutionary origin of terrestrial flora. Current Biology 25, S. R899-R910
Eme, L., Spang, A., Lombard, J., Stairs, C. W. & Ettema, T. J. G. (2017): Archaea and the origin of eukaryotes. Nat. Rev. Microbiol. 15, pp 711–723
Gibbs, S. P. (1978): The chloroplasts of Euglena may have evolved from symbiotic green algae. Canadian Journal of Botany 56 (22), pp 2883–9. doi:10.1139/b78-345
Gould, S. B., Garg, S. G., Martin, W. F. (2016): Bacterial Vesicle Secretion and the Evolutionary Origin of the Eukaryotic Endomembrane System. Trends Microbiol., 24 (7); pp 525-534. doi: 10.1016/j.tim.201603.005. Epub 2016 Mar 31
Kadereit, J. W., Körner, C., Kost, B., Sonnewald (2014): Strasburger Lehrbuch der Botanik, 37. A., Berlin/Heidelberg: Spektrum
Katscher, F. (2004): The history of the terms Prokaryotes and Eukaryotes. Protist, Vol. 155, pp 257–263, http://www.elsevier.de/protist
Keeble, F. (1910): Plant animals. A study in symbiosis. Cambridge: Univ. Press.
Klemmstein, W. (2017): Viren – ein Perspektivenwechsel. Unterricht Biologie 429,41.Jg., S.2-11
Kremer, B.P., Hauck, A. (1996): Algen in Symbiose – ein klassischer Fall für Zwei. Praxis der Naturwissenschaften 45 (1): 19-22
La Scola, B. et al. (2003): A giant virus in amoebae. Science 299 (5615), pp 2033
Lee, R. L. (2008): Phycology. 4th ed..Cambridge (UK): Cambridge Univ. Press
Margulis, L. (1998): Symbiotic planet. A new look at evolution. Amherst (USA, Mass.): Sciencewriters
Margulis, L. ,Sagan, D. (2002): Aquiring genomes. A theory of the origin of species. Basic Books
Martin, W. et al. (2002): Evolutionary analysis of Arabidopsis, cyanobacterial, and chloroplast genomes reveals plastid phylogeny and thousands of cyanobacterial genes in the nucleus. PNAS 99 (19), pp 12246–12251 http://www.pnas.org/content/99/19/12246.full
Mayr, E. (1998): Two empires or three? PNAS 95 (17), pp 9720-9723, http://www.pnas.org/content/95/17/9720.full
McCutcheon, J.P., von Dohlen, C. D. (2011): An Interdependent Metabolic Patchwork in the Nested Symbiosis of Mealybugs. Current Biology 21 (16), pp1366-1372 https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3169327/
Probst, W. (2002): Leben heißt zusammenleben. Unterricht Biologie 280, Jg.26, S. 4-14
Reisser, W. (1992): Algae in Symbiosis: Plants, Animals, Fungi, Viruses, Interactions Explored. Bristol: Inter Press Limited
SAPP, J. (1994): Evolution by Association. New York/Oxford: Oxford University Press
Sapp, J. (2005): The Prokaryote-Eukaryote Dichotomy: Meanings and Mythology. Microbiol. Mol. Biol. Rev. 69 (2), pp. 292-305
Schüßler, A. (2011): The Geosiphon pyriformis symbiosis – fungus „eats“ cyanobacterium. http://www.geosiphon.de/geosiphon_home.html
Spring, A. et al. (2015): Complex archaea that bridge the gap between prokaryotes and eukaryotes. Nature 521, pp 173-179
Stanier, R. Y., van Niel, C.B. (1962): The concept of a bacterium. Arch. Mikrobiol. 42, pp 17–35
Turner, S. et al. (1999): Investigating deep phylogentic relationships among cyanobacteria and plastids by Small Subunit rRNA squence analysis. Journal of Eukaryotic Microbiology 4, pp 327-338
Wang, B. et al. (2010): Presence of three mycorrhizal genes in the common ancestor of land plants suggests a key role of mycorrhizas in the colonization of land by plants. New Phytol. 186(2), pp 514-525. http://onlinelibrary.wiley.com/doi/10.1111/j.1469-8137.2009.03137.x/epdf
Wegener-Parfrey, L. u.a. (2011). Estimating the timing of early eukaryotic diversification with multigene molecular clocks. PNAS 108, S. 13224-13226, http://www.pnas.org/content/108/33/13624.full
Weiss, M. C. et al. (2016): The physiology and habitat of the last universal common ancestor. Nature Microbiol. 16116. http://www.molevol.hhu.de/fileadmin/redaktion/Fakultaeten/Mathematisch-Naturwissenschaftliche_Fakultaet/Biologie/Institute/Molekulare_Evolution/Dokumente/Weiss_et_al_Nat_Microbiol_2016.pdf
Woese, C. R., Fox, G.E. (1977): Phylogenetic structure of the prokaryotic domain: the primary kingdoms. PNAS 74(11), pp 5088–5090. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC432104/
Woese, C.R., Kandler, O., Wheelis, M.L. (1990): Towards a natural system of organisms: proposal for the domains Archaea, Bacteria, and Eucarya. PNAS 87(12), pp 4576-4579 https://www.ncbi.nlm.nih.gov/pubmed/2112744?dopt=Abstract
Zaremba-Niedzwiedzka,K. et al. (2017): Asgard Archaea illuminate the origin of eukaryotic cellular complexity. Nature 541 (Jan.2017), pp 353-358
https://www.arcella.nl/paulinella-chromatophora
http://www.geosiphon.de/geosiphon_home.html
https://microbewiki.kenyon.edu/index.php/Aphids_and_Buchnera