Vorbemerkung
Individuelle Fitness und natürliche Selektion sind zentrale Begriffe der Darwinschen Evolutionstheorie. In diesem Zusammenhang spielte der Begriff des „struggle for life“, des „Kampfes ums Dasein“, eine wichtige Rolle. Daraus wurde im Sozialdarwinismus nicht nur der „Sieg des Stärkeren“ sondern auch das „Recht des Stärkeren“ auf diesen Sieg als natürliches Recht abgeleitet. Dies wurde auch – nicht im Sinne Darwins, aber doch mit Bezug auf seine Theorie – auf die menschliche Gesellschaft übertragen und hatte starke Auswirkungen auf das Erziehungssystem, das lange Zeit auf die Förderung der Einzelleistung und die Qualifikation des Individuums abgestellt wurde.
Schon früh wurde diesen Folgerungen widersprochen, zum Beispiel von dem im englischen Exil lebenden russischen Anarchisten Pjotr Alexejewitsch Kropotkin (1842-1921) in seiner leider in Vergessenheit geratenen Schrift „Mutual Aid“. Auch die Erkenntnisse anderer Naturwissenschaftler zur großen Bedeutung der Kooperation bzw. des Mutualismus für die Evolution der Lebewesen gerieten in der ersten Hälfte des 20. Jahrhunderts in Vergessenheit. Eine Wiederbelebung erfuhren mutualistische Theorien erst wieder durch die bahnbrechenden Arbeiten Lynn Margulis` .
In der Wirtschaft hat Teamwork schon länger eine große Bedeutung. Gefördert durch die Digitalisierung und die elektronischen Medien hat sich in den letzten Jahrzehnten die Forderung nach gemeinschaftlichem Lernen in den Erziehungswissenschaften neu formiert unter den Begriffen „Kooperatives Lernen“ und „Kollaboratives Lernen“. Auch hier beruft man sich nicht nur auf Erkenntnisse der Pädagogik und der Sozielwissenschaften sondern auch auf die Biologie. Aus den Erkenntnissen über die Rolle der Kooperation bei der Evolution der Lebewesen leitet man ab, dass es eine genetische Disposition der Menschen für Kooperation und gemeinschaftliches Lernen geben muss (vgl. z. B. E.O. Wilson 2012).
Vor 20 Jahren, im Dezember 2010, erschien das von mir herausgegebene Unterricht Biologie Heft 280 „Miteinander“. Ich finde, angesichts dieser Entwicklungen ist es immer noch aktuell. Deshalb soll hier der Basisartikel im ungekürzten Entwurf mit einigen kleinen Korrekturen veröffentlicht werden:
Leben heißt Zusammenleben
„Don’t compete,combine!“ Kropotkin 1902
„Du sollst das Stroh zu Gold mir spinnen, ich brauche davon große Mengen“, fordert der Prinz die Müllerstochter auf und im Märchen bedient sich das arme Mädchen der besonderen Kenntnisse von Rumpelstilzchen. Auch wenn es wohl nie gelingen wird aus Gras Gold zu produzieren, so sind andere Transsubstantiationen doch fast genau so wunderbar: z.B. die Umwandlung von Gras in Milch, die von den Kühen in großem Maßstab für uns Menschen geleistet wird. Allerdings nicht von den Kühen alleine. Nur die Mikroben, in erster Linie die Bakterien, die in ihrem Pansen leben, schaffen es, den Hauptbestandteil des Grases, die Zellulose, aufzuschließen und damit der Verdauung und letzten Endes der Umwandlung in Milch zugänglich zu machen,
Herbivoren, Konsumenten erster Ordnung, sind wichtige Bestandteile von Ökosystemen, sie haben entscheidenden Anteil an der Regulation von Stoff- und Energiefluss, und sie alle sind dabei auf Verdauungshelfer in ihrem Darm angewiesen. Außerdem sind viele Herbivoren, wie die Vorfahren unserer Hausrinder, die Auerochsen, soziale Tiere, die in großen Herdenverbänden zusammenleben, in denen es Rangordnung und Kommunikation, gemeinschaftliche Aufzucht der Jungtiere und gegenseitige Hilfe gibt. Kein Wunder, dass gerade solche sozial lebenden Tiere vom Menschen domestiziert und genutzt wurden, eine neue Form der Wechselbeziehungen zweier Arten- durchaus nicht nur zum Vorteil des Menschen, mindestens, wenn man den genetischen Erfolg und die heutige Verbreitung der Haustierarten betrachtet. Bei der Verarbeitung der Milch schließlich bedient sich der Mensch wiederum mikrobieller Lebewesen, die man schon beinahe als „Hausmikroben“ bezeichnen könnte.
Schließlich gibt es einen weiteren Aspekt des neuen Miteinander von Menschen und Haustieren: Durch die Domestikation kamen neue infektiöse Keime in die menschlichen Populationen wie Pocken, Masern oder Influenza. Die Viehzüchter wurden dagegen allmählich immun, menschliche Populationen ohne Haustiere blieben sehr anfällig . Dies ist mit ein Grund für den raschen Niedergang indigener Kulturen nach der Kolonisation durch Europäer bzw. Asiaten (vgl. Diamond 1997)..
So gibt dieses Beispiel „Milch“ einen Eindruck von der Vielschichtigkeit des Miteinander des Lebens und der Lebewesen auf unserem Planeten.
Einmal zeichnet sich Leben durch Individualität und damit durch Grenzen und Grenzziehungen aus, zum anderen sind alle diese Grenzen – angefangen von den intrazellulären Membranen – „semipermeabel“. Wechselwirkungen über Barrieren hinweg sind ein Charakteristikum aller Lebensvorgänge und auch aller Lebewesen, insbesondere auch Wechselwirkungen mit anderen Lebewesen.
Bei der weiteren Darstellung dieser Wechselbeziehungen wollen wir sie zunächst in intraspezifische und interspezifische Beziehungen unterteilen, auch wenn dies gerade bei den Gruppen schwierig ist, bei denen sich – wie bei den Prokaryoten – Arten nicht eindeutig definieren lassen. Ein weiterer Abschnitt wird sich mit den Wechselbeziehungen innerhalb von Ökosystemen beschäftigen und schließlich soll die Rolle des Menschen als „hypersoziales Wesen“ in den Blick genommen werden.
Interspezifische Wechselbeziehungen
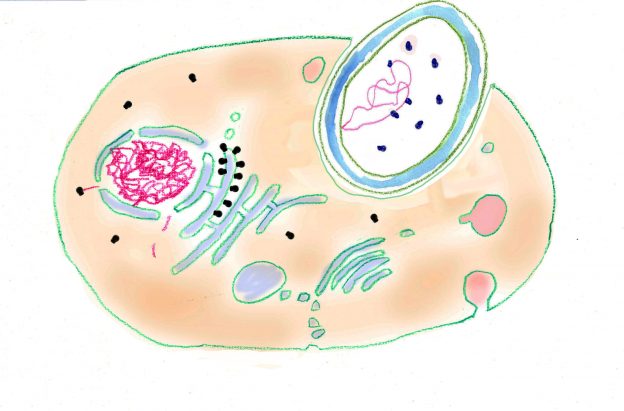
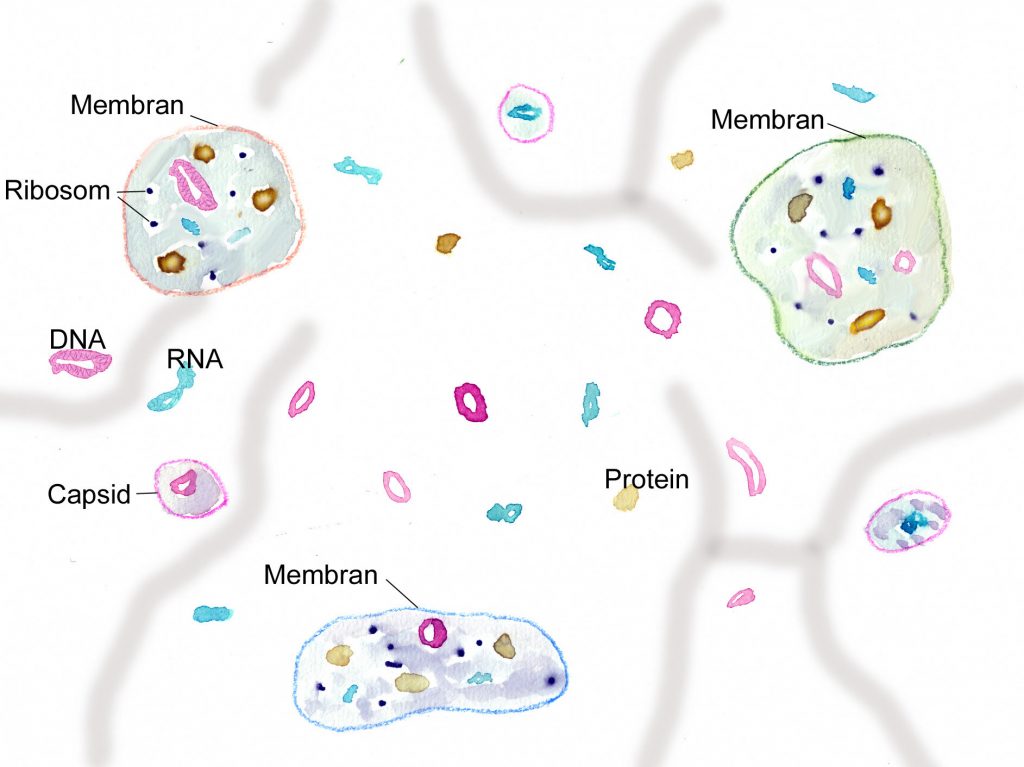
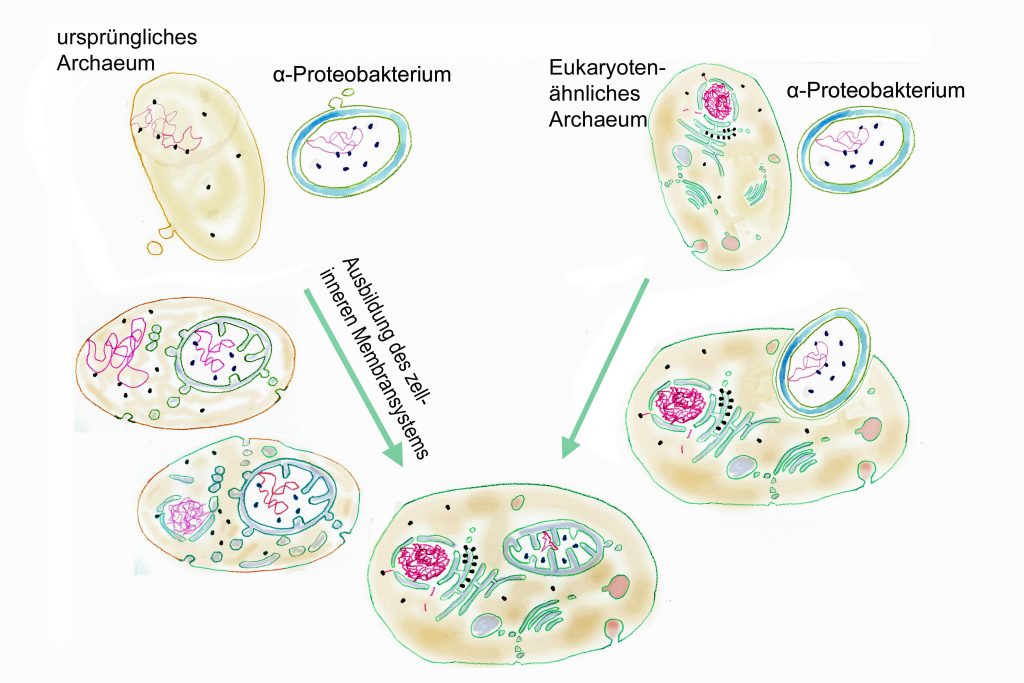
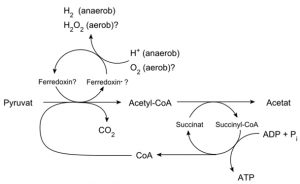
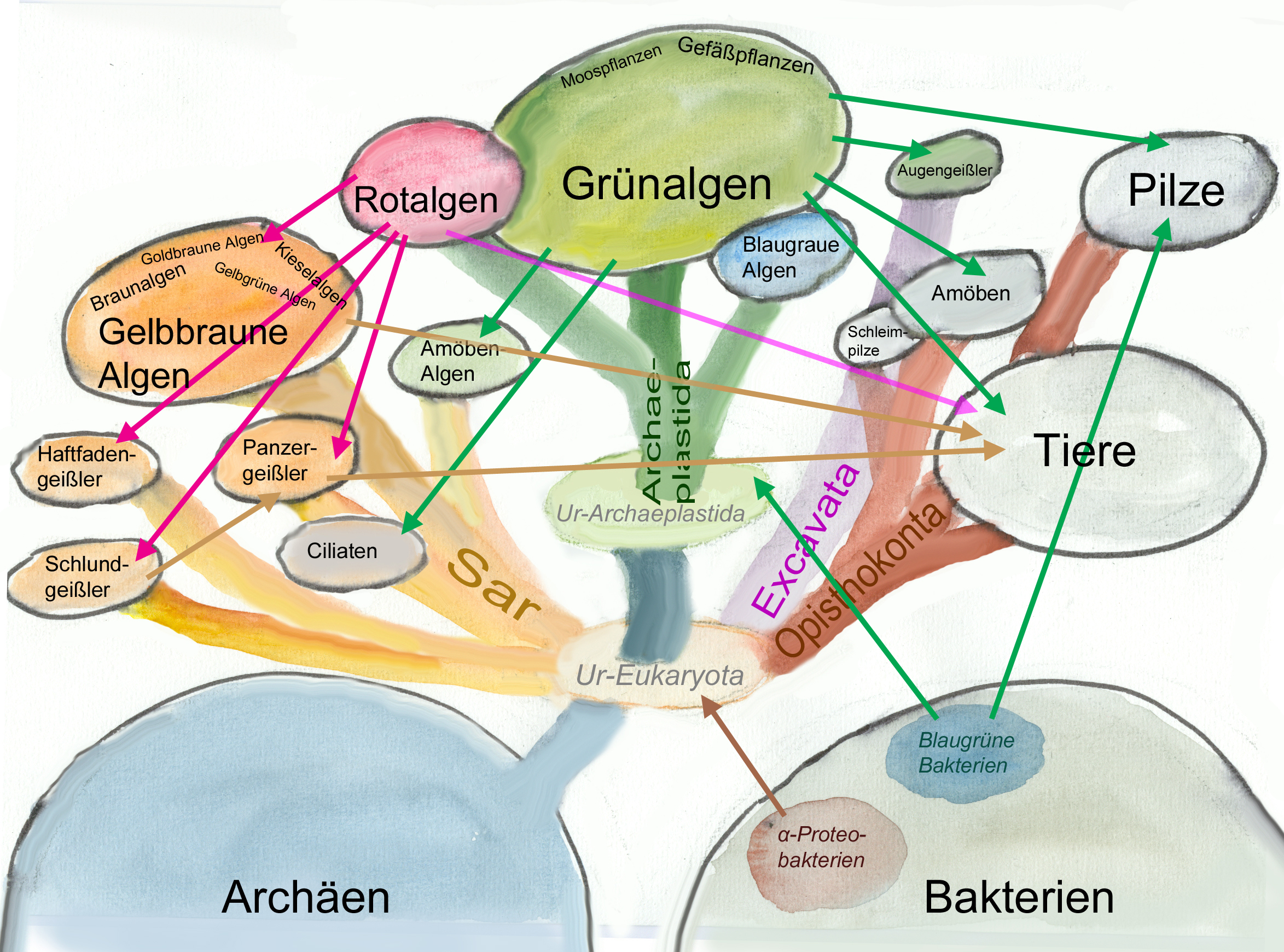
Forschungsarbeiten zum Thema „Symbiose“ bzw. „Kooperation“ haben lange Zeit eine relativ untergeordnete Rolle in der Biologie gespielt. Gerade im Hinblick auf die biologische Evolution wurde dieses wichtige Prinzip bis heute nicht ins rechte Licht gerückt – möglicherweise als Folge des unglücklichen Begriffs vom „Kampf ums Dasein“ und den mit diesem Schlagwort verbundenen populärwissenschaftlichen und biologistischen Interpretation der Evolutionstheorie (Sozialdarwinismus). Dabei gab es in der zweiten Hälfte des 19. Jahrhunderts durchaus wichtige Ansätze und die Zukunft weisende Erkenntnisse (vgl. Sapp 1994). Anton de Bary, ursprünglich Pflanzenpathaloge und Mykologe, definierte Symbiose als das Zusammenleben verschiedener Arten, wobei über den Nutzen für die einzelnen Arten noch nichts ausgesagt war. Er legte 1866 den Grundstein für die Erkenntnis, das Flechten einen Doppelorganismus aus Pilz und Alge darstellen. Der Begriff des Mutualismus wurde von dem Belgier Pierre-Joseph van Beneden 1873 geprägt (Vorlesung: Ein Wort zum Sozialleben Niederer Tiere). Albert Bernhard Frank – nach ihm sind die N2-assimilierenden Actinobakterien in den Erlenknöllchen „Frankia“ benannt – prägte 1877 den Begriff „Symbiotismus“ für alle Formen des engen Zusammenlebens verschiedener Arten ohne Berücksichtigung , wem dieses Zusammmenleben Vorteile oder Nachteile bringt. 1885 entdeckte er die Mykorrhiza. Der Berliner Karl Brandt und der Edinburgher Pattrick Geddes beschäftigten sich besonders mit „grünen“ niederen Tieren wie Hydra, Spongilla und Stentor. Geddes veröffentlichte 1881 einen Aufsatz über „Symbiosis of Algae and Animals“. Auch die Endosymbionten-Theorie der Eucyten wurde schon im letzten Jahrhundert geboren. A. F. W. Schimper äußerte 1883 als Erster die Vermutung, dass Plastiden Algen-Endosymbionten in Zellen sein könnten. Zu Beginn des 20. Jahrhunderts wurden diese Idee von den russischen Biologen Konstatine Sergejewitsch Mereschkowskii und Andrei Sergejewitsch Famintsyn aufgegriffen. Der von Famintsyn versuchte experimentelle Beweis – die isolierte in vitro Kultur von Plastiden und Mitochondrien – misslang allerdings. Die Theorie geriet zunächst in Vergessenheit. Erst in den letzten zwei Jahrzehnten des 20. Jahrhunderts wurde sie vollständig anerkannt (vgl. z.B. Margulis 1981, Schwemmler/ Schenk 1980). Es gilt heute als gesichert, dass es bei verschiedenen Algen zu mehrfachen Endosymbiosen (sekundären und tertiären Endosymbiosen) gekommen ist. Diese kamen dadurch zustande, dass eukaryotische fotosynthetisch aktive Algen durch Phagocytose aufgenommen und dann nicht vollständig verdaut wurden. Heute noch kann man diese Mehrfachendosymbiosen an der Zahl der die Chloroplasten umgebenden Membranen erkennen. Teilweise finden sich auch noch Kernreste in den Chromatophoren.
Die Beziehungen verschiedener Arten kann man – entsprechend der Einteilung in Kasten 1 – in Konkurrenz, Karpose (= Parabiose), Symbiose und Antibiose einteilen. Der Nutzen oder Schaden, den die Wechselbeziehung den Partnern gibt, kann durch Plus- und Minuszeichen bzw. durch eine Null bei Indifferenz ausgedrückt werden. Konkurrenz erhält dann zwei Minuszeichen, Karpose ein Plus und eine Null, Symbiose zwei Pluszeichen und Antibiose ein Plus- und ein Minuszeichen. Im Gegensatz zu dieser Einteilung fasste de Bary (1879) den Begriff der Symbiose weiter. Er verstand darunter einen Überbegriff für Parasitismus, Symbiose und Karopse, schloss allerdings Vereinigungen kurzer Dauer (z.B. das Zusammenwirken von bestäubenden Insekten und Blütenpflanzen) aus. Diese Symbiosedefinition hat sich vor allem im angelsächsischen Sprachraum bis heute erhalten. In der folgenden Darstellung halten wir uns jedoch an den hier gebräuchlicheren Einteilungsvorschlag im Kasten.

Konkurrenzausschlussprinzip
Nach Hardin (1960) kann die Konkurrenzsituation zwischen zwei Arten kein Dauerzustand sein: Entweder wird eine Art verdrängt oder sie wandelt sich in ihren Ansprüchen und es kommt zu einem räumlichen (Allopatrie) oder ökologischen (Sympatrie) Nebeneinander. Dieses Konkurrenzausschlussprinzip ist eng gekoppelt mit der Definition der ökologischen Nische. Eine solche kann definitionsgemäß ebenfalls nur von einer Art gebildet werden. In Wirklichkeit sind die Verhältnisse allerdings etwas komplizierter. Dies hängt vor allem damit zusammen, dass es unter natürlichen Bedingungen keine Konstanz der Umweltfaktoren gibt. Im Laborversuch konnte Park 1954 und 1962 zeigen, dass zwei Mehlkäferarten mit nahezu identischen Umweltansprüchen sich unter Laborbedingungen gegenseitig verdrängen und dass es auf die Umweltbedingungen ankommt, ob die eine Art die andere oder die andere die eine verdrängt. Wenn aber unter natürlichen Bedingungen z.B. das Klima dauernd schwankt, so können auch zwei oder mehr Arten mit nahezu gleichen Ansprüchen in einem Lebensraum erhalten bleiben.
Symbiosen im engeren Sinne
Unter Symbiose in diesem Sinne versteht man sowohl langdauernde, eventuell sogar lebenslange enge Gemeinschaften, wie sie zum Beispiel zwischen den genannten Darmbakterien und den Rindern , zwischen Korallen und einzelligen Zooxanthellen oder auch zwischen Einsiedlerkrebs und Aktinie beschrieben werden als auch Gemeinschaften, die nur von kurzer Dauer sind. Hierzu gehören z.B. die Beziehungen zwischen blütenbestäubenden Insekten und Blüten (vgl. UB 236 Pflanzen und die sie bestäubenden Insekte). Andere Beziehungen – auch als „Allianz“ bezeichnet – kennzeichnen vorübergehende lockere Gemeinschaften wie die zwischen Madenhackern und Herbivoren oder zwischen großen Rifffischen und Putzerfischen.
Einige Beispiele:
Sehr charakteristisch sind Stoffwechselsymbiosen zwischen Tieren und Prokaryoten und Pilzen. Dies hängt damit zusammen, dass bei Pilzen und insbesondere auch bei Prokaryoten eine Vielzahl von Stoffwechselwegen entwickelt sind, die bei Eukaryoten fehlen. Durch die Symbiose können sich die Eukaryoten so Nahrungs- und Energiequellen erschließen, die anderenfalls verschlossen geblieben wären. Gleichzeitig profitieren die endosymbiotischen Mikroben von den Stoffwechselendprodukten ihrer Symbiosepartner und von den relativ geschützten Lebensräumen, die ihnen von diesen geboten werden.
Eine besonders enge Symbiose dieser Art besteht zwischen Blattläusen und den endocytosymbiotischen Bakterien der Gattung Buchnera, die in besonders großen Darmzellen (Bakteriocyten) leben. Die Endosymbionten werden von Generation zu Generation über die Eier weitergegeben. Buchnera ist eng verwandt mit Escherichia coli aber im Gegensatz zu diesem weit verbreiteten Darmbakterium ist ihr Genom wesentlich kleiner. Dafür sind in einer Zelle über 100 Kopien enthalten. Eine vollständige Genomanalyse von Buchnera ergab, dass keine Gene für Zelloberflächen-Lipopolysaccharide und Phospholipide vorhanden sind. Ebenso fehlen die meisten Regulatorgene und Gene, die der Verteidigung der Zellen nach außen dienen. Das enge Zusammenleben mit den Wirten wird dadurch deutlich, dass von Buchnera alle für seinen Wirt essentiellen Aminosäuren produziert werden. Dafür sind mindestens 55 Gene verantwortlich. Umgekehrt werden von dem Bakterium keine für den Wirt nicht essentiellen Aminosäuren produziert. Diese Komplementarität zeigt, dass die Symbiose schon sehr lange erfolgreich arbeitet. So bilden Blattläuse keine stickstoffhaltigen Exkrete, vielmehr produzieren sie Glutamin und dieses wird von den Bakterien als Ausgangsstoff für die Produktion von essentiellen Aminosäuren verwendet. Da Buchnera sogar seine Außenmembran vom Wirt erhält, kann man sagen, dass bei dieser Symbiose ein Stadium erreicht ist, das Buchnera schon fast als ein Zellorganell erscheinen lässt.
Noch komplizierter ist die Doppelendocytobiose in Darmzellen von Motten-Schildläusen. Wie durch Genanalysen nachgewiesen, enthalten die Bakterien in den Darmzellen ein weiteres endosymbiontisches Bakterium (von Dohlen, 2001: 433-436).
Viele ähnliche Beziehungen kommen bei Holz bzw. Zellulose fressenden Insekten wie Tabakskäfer, Borkenkäfer und Termiten vor. Auch blutsaugende Egel, Zecken und Läuse bessern die Inhaltsstoffe ihrer relativ einseitigen Nahrung durch symbiontische Darmbakterien auf. Sie können in besonderen Darmzellen (Bacteriocyten, auch Mycetome genannt), in Darmaussackungen oder auch frei im Darmlumen vorkommen.
Ein anderer Stoffwechsel-Symbiosetyp besteht zwischen Höheren Pflanzen und Prokaryoten, die das Luftstickstoffmolekül (N2) assimilieren können. Besonders bekannt sind diese Stickstoffendosymbionten der Gattung Rhizobium von den Hülsenfrüchtlern (Wurzelknöllchen). Bei anderen Höheren Pflanzen wie Erlen oder Sanddorn kommen stickstoffbindende endosymbiontische Aktinobakterien der Gattung Frankia vor. Schließlich können auch Blaugrüne Bakterien symbiontisch mit Höheren Pflanzen zusammenleben z.B. das Blaugrüne Bakterium Anabena azollae in besonderen Taschen des Schwimmfarns Azolla und andere Blaugrüne Bakterien in korallenartigen in den Luftraum ragenden Wurzeln von Cycadeen.
Noch nicht sehr lange bekannt sind die symbiotischen Beziehungen zwischen Sphagnen und methanotrophen Bakterien. Die Bakterien, die in den Wasserspeicherzellen der Sphagnen leben, nutzen die Oxidation des in tieferen Torfschichten gebildete Methan zur Energiegewinnung und sind gleichzeitig dazu in der Lage, Luftstickstoff zu assimilieren. Sie profitieren von der Sauerstoffproduktion und den teilweise abgegebenen Kohlenhydraten der Photosynthese betreibenden Sphagnum –Chlorocyten.
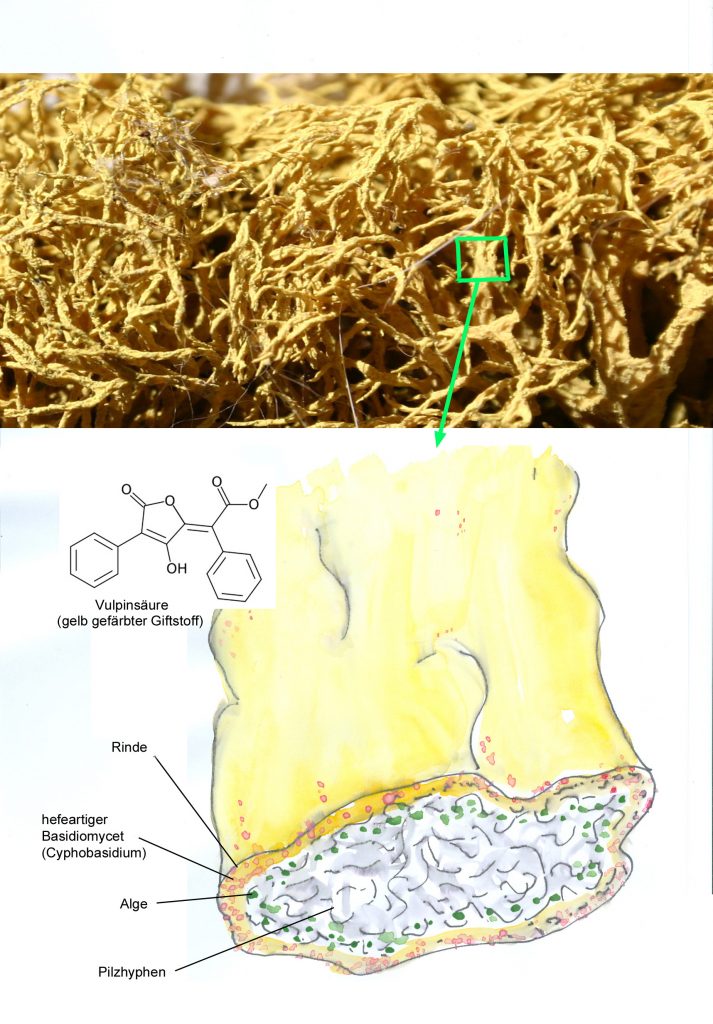
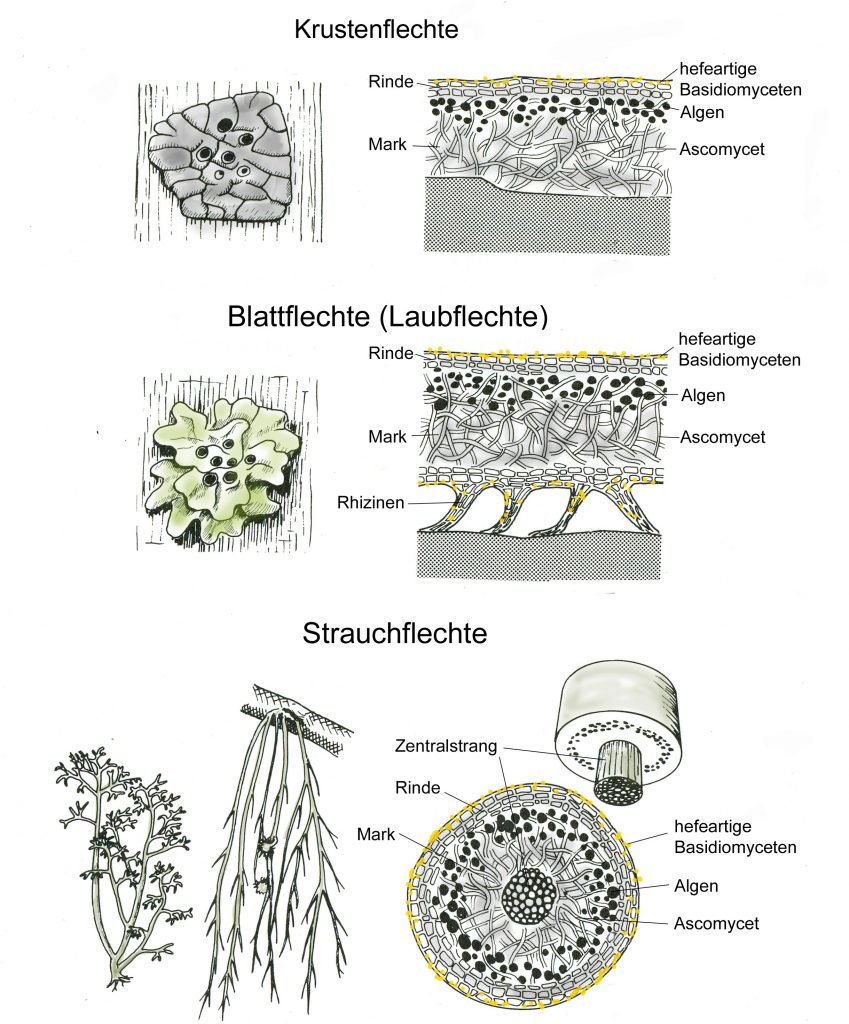
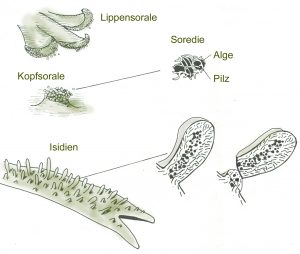
Blaugrüne Bakterien kommen auch als Symbiosepartner bei Flechten vor. Noch wichtiger sind bei dieser Symbiose aber eukaryotische Algen und zwar aus der Gruppe der Grünalgen, die mit Pilzarten eine sehr enge Gemeinschaft eingegangen sind. Hier ist durch die Symbiose eine völlig neue morphologische, ökologische und physiologische Einheit entstanden: Flechten sehen anders aus als die beiden Partner alleine, sie können völlig andere Lebensräume, auch extreme Standorte in der Arktis in Hochgebirgen oder in Wüsten, besiedeln und es gibt zahlreiche typische Flechteninhaltsstoffe wie z.B. Depside, Butenoide oder Azofarbstoffe, die jeweils vom einen der beiden Partner nicht gebildet werden können.
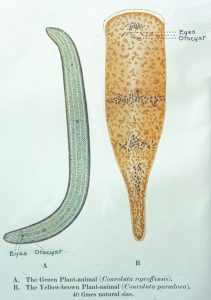
Außer in Flechten spielen Algen als Synbionten auch in vielen niederen Tieren eine bedeutende Rolle, so in den Polypen der Korallen, in marinen Würmern und Schnecken, in verschiedenen Muscheln und Schwämmen (vgl. UB 225 Algen, UB 254 Riffe). In allen diesen Fällen werden die heterotrophen Tiere durch die Algensymbionten teilweise autotroph. Bei einigen Strudelwürmern (z.B. Convoluta roskovensis) kann dies bis zum Verlust des eigenen Darmkanals gehen. Keeble (1910) hat hierfür die treffende Bezeichnung „Plant animals“ – Pflanzentiere – geprägt.
Eine weitere typische Symbiose zwischen Prokaryoten und Tieren stellen die verschiedenen Leuchtsymbiosen dar. Meerestiere wie Manteltiere, Tintenfische und Knochenfische nehmen die im Seewasser weit verbreiteten Leuchtbakterien in besonderen Organen als Symbionten auf und betreiben mit der Bakterienkolonie besondere Leuchtorgane.
Auch zwischen vielzelligen Tieren und Pflanzen gibt es zahlreiche symbiotische Gemeinschaften. Besonders bemerkenswert sind in diesem Zusammenhang die sogenannten Ameisenpflanzen oder Myrmecophyten. Sie stellen Hohlräume in Blättern, Stielen oder Wurzeln berei, die vor allem von Ameisen aber auch von anderen Kleintieren bewohnt werden. Besonders zahlreich kennt man solche Ameisenpflanzen aus Südostasien. Mehr als 150 Arten aus 27 Pflanzenfamilien wurden beschrieben.
Der baumförmige Schmetterlingsblütler Humboldtia laurifolia aus Sri Lanka hat hohle Internodien mit einem sich selbst öffnenden Eingang. Zusätzlich zu diesen „Wohnhöhlen“ (Domatium) bietet der Baum eine Reihe von extrafloralen Nektarien, die den Bewohnern gleichzeitig Futter liefern. Die Hohlräume werden vor allem von Ameisenarten besucht und besiedelt, besonders häufig von Technomyrmex albipes. Aber die Besiedelung kann auch durch verschiedene Ameisenarten erfolgen sogar in unmittelbarer Nachbarschaft. In einer gründlichen Untersuchung (Krombein et al. 1999) wurden weitere zehn Ameisenarten, verschiedene andere Insekten sowie Pseudoskorpione und Ringelwürmer als regelmäßige Bewohner der „Wohnhöhlen“ nachgewiesen. Bei einigen dieser Arten handelt es sich um eine sehr enge Gemeinschaft mit Humboldtia. Eine Vernichtung dieser Baum-Art würde auch zum Verschwinden der symbiontischen Bewohner führen.
Für die Pflanzen bringen die besiedelnden Ameisen vor allem einen Schutz gegen Fressfeinde. Die Wirksamkeit dieses Pflanzenschutzes wurde für das Symbiosepaar Crematogaster-Ameise und Ameisenpflanze Macaranga (Wolfsmilchgewächse) genauer untersucht. In diesem Falle werden von der Ameisenpflanze auch noch fett- und eiweißreiche Futterkörperchen für die Ameisen bereit gestellt. Die Ameisen revanchieren sich dafür, indem sie ständig die Oberfläche ihres Wirtsbaumes absuchen und diesen dabei von allem Fremdmaterial reinigen. Sie entfernen Insekteneier ebenso wie Raupen, Käfer und andere pflanzenfressende Gliedertiere. Auch pilzliche Krankheitserreger werden von den Ameisen beseitigt. Man konnte nachweisen, dass Macaranga mehr als 80 Prozent seiner Blattfläche verliert, wenn man die symbiontischen Ameisenkolonien entfernt (Linsenmaier, Heil 2001). Es konnte nachgewiesen werden, dass das Pflanzenhormon Jasmonsäure bei Macaranga die Blattnektarproduktion steuert (Boland et al.2001): Kommt es zu einer starken Schädigung durch Insektenfraß, wird die Hormonausschüttung erhöht und dies wiederum führt zu einer stärkeren Nektarproduktion. Dadurch lockt die Pflanze Ameisen, Wespen und andere Nektarkonsumenten an, die ihr helfen, sich gegen die Fraßfeinde zu verteidigen. Damit ist eine Form der Wechselwirkung zwischen Höheren Pflanzen angesprochen, deren Erforschung erst in jüngerer Zeit begonnen hat. Das Methyljasmonat ist einer von vielen Stoffen, der der Kommunikation zwischen Pflanzen dient. Pflanzen, die von Herbivoren z.B. Raupen befallen werden, produzieren in erhöhtem Maße Signalstoffe wie Jasmonat und diese bewirken bei anderen Pflanzen – auch bei anderen Pflanzenarten – eine verstärkte Produktion von für die Pflanzenfresser schädlichen Stoffen. Die Beziehung zwischen Blütenbestäubern und bestäubten Pflanzen ist in der Regel weniger eng. Es gibt jedoch auch hier Beispiele einer engen Gemeinschaft zweier Arten, die für beide lebensnotwendig ist. Dies gilt etwa für die komplizierten Wechselwirkung von Feige und Feigen-Gallwespe oder von Yucca und Yucca-Motte (Abb. ). Im natürlichen Lebensraum der Yucca-Arten im westlichen Nordamerika lebt ein kleiner Nachtfalter von etwa 13 mm Körperlänge, die Yucca-Motte (Pronuba yuccasella). Die Begattungsflüge der Yucca-Motten finden in der Dunkelheit statt. Das befruchtete Weibchen beginnt noch in der Nacht, die weißen duftenden Yuccablüten aufzusuchen und dort Pollen zu sammeln. Mit besonderen Fortsätzen der Kiefertaster wird der Pollen zu einem Klumpen geformt, der oft mehrere Millimeter Durchmesser haben kann und zwischen Kopf und Ansatz der Vorderbeine eingeklemmt und mit den Tentakeln seitlich festgehalten wird. Mit diesem Pollenpaket fliegt das Weibchen zu einer anderen Blüten derselben Art. Auf den dicken wachsachtigen Staubfäden sitzend, stößt es dann seine Legescheide durch die weiche Wand des Fruchtknotens in desse Höhlung hinein und legt an den Samenanlagen ein Ei ab. Sodann wandert das Tier entlang dem Stempel bis zur Narbe, stopft etwas von dem mitgebrachten Pollen in eine der drei Narbenfurchen oder in den dort offenen Griffelkanal, legt wieder ein Ei in den Fruchtknoten und so fort, bis sich eine Anzahl von Eiern im Inneren des Fruchtknotens befindet. Bald darauf wachsen die Pollenschläche von der Narbe durch den Griffelkanal zu den Samenanlagen und die Eizellen werden befruchtet. Während die Samenanlagen zum Samen heranwachsen, schlüpfen auch die jungen Räupchen aus den Eiern und sie beginnen, die heranwachsenden Samenanlagen aufzufressen. Nach einem Monat sind die Raupen ausgewachsen und verlassen den Fruchtknoten. Sie verpuppen sich in der Nähe der Yuccapflanze im Erdboden. Da die Raupen bis zum Verlassen des Fruchtknotens nur einen Teil der zahlreichen Samenanlagen verzehren, können sich viele noch zu reifen Samen entwickeln.
Antibiosen
Im Gegensatz zur Symbiose kennzeichnet die Antibiose eine Beziehung, die für einen der beiden Partner vorteilhaft, für den anderen aber schädigend ist. Ganz eindeutig gilt dies z.B. für die Beutegreifer-Beute-Beziehung . Nicht ganz so eindeutig ist dies für die für die Beziehung, die zwischen Pflanzen und Pflanzenfressern besteht, da die Konkurrenzkraft bestimmter Pflanzen durch regelmäßige Beweidung gestärkt wird. Auf solche Nahrungsketten soll jedoch hier nicht weiter eingegangen werden.
Demgegenüber bezeichnet man als Parasitismus, wenn ein Parasit einen Wirt ausnützt ohne dessen unmittelbaren Tod zu bewirken. De Bary definierte den Parasitismus folgendermaßen: „… der vollständige Parasitismus, d.h. jene Einrichtung, bei welcher ein Tier oder eine Pflanze den ganzen Vegetationsprozess durchmacht auf oder in einem anderen, einer ungleichnamigen Spezies angehörenden Organismus. Letzterer dient jenem, dem Parasiten, ausschließlich als Wohnort und liefert ihm sein gesamtes Nährstoffmaterial. Er ist in jeglichem Sinne des Wortes sein Wirt. Und jener lebt auf Kosten des Wirtes insofern sein Nährstoffmaterial die Lebendkörpersubstanz oder die zur eigenen Ernährung aufgenommene Nahrung dieses ist.“ Dabei weist schon De Bary darauf hin, dass es natürlich möglich sein wird, Parasiten auch außerhalb des Wirts künstlich am Leben zu erhalten, indem man ihnen eine geeignete Nährlösung bietet.
Eine für Parasiten besonders typische Erscheinung ist, dass sie oft auf mehrere Wirtsarten angewiesen sind, die sie im Laufe ihres Lebenszyklus sukzessive besiedeln. Häufig ist dieser Wirtswechsel auch noch mit einem Generationswechsel des Parasiten verbunden.
So gibt es vermutlich kaum eine höhere Pflanzenart, die nicht von einem oder mehreren Rostpilzen parasitiert wird. Eine große Zahl von Rostpilzen parasitieren auf Nutzpflanzen und sie sind deshalb für den Menschen von besonderer Bedeutung. Sicherlich ist dies ein Grund dafür, dass der Lebenszyklus vieler Rostpilze relativ gut erforscht ist (Gäumann 1959). Stellvertretend für die komplizierten Beziehungen der Rostpilze zu ihren Wirtspflanzen sei der Getreiderost (Puccinia graminis) erwähnt. Dieser Pflanzenparasit entwickelt sich einmal auf der Berberitze, zum anderen auf Getreidearten. Auf der Berberitze wächst das haploide Stadium des Basidiomyceten, auf der Getreidepflanze das Zweikernstadium. In überwinternden zweikernigen Dauersporen kommt es zur Kernverschmelzung und anschließend zur Meiose und zur Basidienbildung.
Nachdem der Entwicklungszyklus des gefährlichen Getriederostes aufgeklärt war, hat man in den 30er und 40er Jahren versucht, durch Ausrotten der Berberitze auch dem Rostpilz die Lebensgrundlagen zu entziehen. Dies gelang aber nicht, da in milden Wintern auch ungeschlechtlich produzierte Sporen überdauern und immer wieder zu einer Infektion der Getreidepflanzen führen können. Im übrigen werden solche Pflanzenparasiten immer durch große Monokulturen besonders gefährlich. Unter natürlichen Bedingungen können sich die Pflanzen gegen Parasiten sowohl tierlicher als auch pilzlicher Art recht gut verteidigen. Dabei kommt es teilweise auch zu einer Wechselwirkung zwischen recht verschiedenen Parasitenarten. So werden vom Verticillium-Pilz befallene Baumwollpflanzen weniger von parasitären Milben aufgesucht als nicht befallene und umgekehrt kann kein (kurzfristiger) Milbenbefall die Pflanzen resistenter gegen Pilzbefall machen (Martin 2002, S. 54/55).
Besonders zahlreiche Parasiten mit komplizierten Lebenszyklen kennt man vom Stamm der Plattwürmer (Plathelmintes). Typisch für die Saugwürmer (Trematoda), einer Klasse der Plathelminthes, ist eine endoparasitische Lebensweise in Darm, Leber, Lunge, Bindegewebe und Blutgefäßsystemen von Wirbeltieren. Sie haben einen relativ komplizierten Generationswechsel, der gleichzeitig mit einem Wirtswechsel verbunden ist: Aus den befruchteten Eiern der Tiere, die im Hauptwirt leben, schlüpfen in der Regel Wimpernlarven (Miracidien), die im ersten Zwischenwert zur Sporocyste werden. Aus der Sporocyste entstehen sogenannte Redien, die im zweiten Zwischenwirt zu Cercarien heranwachsen. Aus ihnen entwickeln sich, nachdem sie von Wirtstieren aufgenommen wurden, die adulten Geschlechtstiere. Bekannt ist das Beispiel des Kleinen Leberegels aus den Gallengängen von Schafen mit den Zwischenwirten Heideschnecke bzw. Zebraschnecke und Ameise. Das besondere an dieser Art von Parasitismus ist, dass der Parasit in diesem Fall die Ameise veranlasst, sich an Pflanzenstängeln festzukrallen. Dadurch wird sie besonders leicht von Schafen gefressen, was der weiteren Verbreitung des Parasiten dient. So abenteuerlich diese komplizierte, angepasste Lebensweise erscheint, so hat sich in jüngerer Zeit gezeigt, dass sie doch nicht einmalig ist. Ähnliche Erscheinungen kennt man von anderen parasitischen Trematoden: Microphallus piriformis lebt einmal in einer Strandschnecke (Littorina saxatilis), zum anderen in der Heringsmöwe. Es wurde nachgewiesen, dass von Trematoden befallene Strandschnecken die Tendenz haben, aufwärts zu kriechen, also in eine Position, in der sie leichter von Möwen gefressen werden können (MacCarthy 2000, 1161-1166). Befallene Schnecken verändern auch ihre Verhaltensweise bezüglich der Gezeiten. Im Gegensatz zu nichtbefallenen, kriechen sie gerade bei fallender Tide aufwärts. Nicht nur von Wirbellosen sondern sogar von Säugetieren kennt man eine solche parasitenbewirkte Verhaltensänderung: Ratten, die von dem Einzeller Toxoplasma gondii befallen sind, den sie vor allem aufsammeln, wenn sie Katzenkot fressen, werden neugieriger und weniger furchtsam. Das lässt sie zu einer leichteren Beute für Katzen werden und hilft so Toxoplasma, in seinen Hauptwirt zurückzukehren ( Berdoy 2000,1591-1594).
Karposen
Auf die große Zahl der Beziehungen, die für einen Partner mehr oder weniger vorteilhaft, für den anderen jedoch nicht schädigend sind, sei hier nur knapp eingegangen. Hierher gehören die Wohngemeinschaften (z.B. Fuchs und Brandgans) oder auch der zeitweilige Aufenthalt in Körperhöhlen von anderen Tieren. Die Nadelfische aus der Familie der Carapidae kommen mit etwa 25 Arten in wärmeren und warmtemperierten Meeren vor. Sie wohnen alle in Actinien, Seesternen, Seegurken, Feuerwalzen oder in Muscheln. Genauer wurde Carapus acus, ein mediterraner Nadelfisch untersucht. Er verlässt seien Wohnort Seegurke nur nachts. Um in die Seegurke hinein zu gelangen, schwimmt er mehr oder weniger senkrecht stehend mit wedelndem Schwanz um sie herum. Immer wieder wird dann der Versuch unternommen, am Hinterende in den Wirt einzudringen. Dazu stellt sich der Nadelfisch mit seinem Kopf dicht vor die Kloakenöffnung, führt seine Schwanzspitze am Körper entlang nach vorn und wahrscheinlich in dem Augenblick, in dem das Atemwasser in die Seegurke strömt, sich schnell umwendend, stößt er sein Hinterende in die Kloake. Dann dringt der Fisch nach und nach immer tiefer ein. Der Fisch dringt zunächst in die Wasserlunge der Seegurke ein, durchbricht diese aber dann, um sich in der Leibesöhle aufzuhalten. Während viele Nadelfische die Holothurien und andere Wirte nicht weiter schädigen, konnte man für Carapus acus nachweisen, dass er sich von den Geschlechtsdrüsen der Seegurke ernährt. Andere Arten kommen im Muscheln vor. Wenn die Fische in der Muschel sterben, werden sie als Fremdkörper mit einem Perlmuttüberzug versehen (z.B. Carapus homei aus der Karibik).
Auch die actinienbewohnenden Clownfische oder die als Muschelwächter bezeichneten Kurzschwanzkrebse, die in der Mantelhöhle von Muscheln zu finden sind, wären hier zu nennen. Die Aktinien könnten allerdings auch von den Futterresten der Clownfische profitieren, weshalb diese Partnerschaft oft auch als echte Symbiose bezeichnet wird.
Eine besonders große Rolle spielt die sogenannte Epökie (Aufsitzertum) – Lebewesen siedeln auf anderen. Besonders eindrücklich wird dieses Prinzip in den üppigsten Lebensräumen, wie Regenwäldern oder Korallenriffen, demonstriert. Aber auch bei uns gibt es viele „Epiphyten“ (Moose und Flechten auf Baumrinde) und „Epizoen“ (z.B. Seepocken auf Muschelschalen oder Krebspanzern, Glockentierchenkolonien auf Wasserflöhen und Ruderfußkrebsen.) Eine besondere Form der Wechselwirkung ist die der Transportgemeinschaft (Phoresie). Dungmilben und Fadenwürmer heften sich an Mistkäfer an, andere Milben werden von Weberknechten transportiert. Schiffshalter lassen sich von großen Fischen mitnehmen.
Intraspezifische Kooperation
„Wo ich auch immer das Tierleben in reicher Fülle auf engem Raum beobachtete, sah ich gegenseitige Hilfe und gegenseitige Unterstützung sich in einem Maße betätigen, dass ich in ihnen einen Faktor von größter Wichtigkeit für die Erhaltung des Lebens und jeder Spezies sowie ihrer Fortentwicklung zu ahnen begann.“ (Kropotkin 1902).
Artgenossen sind evolutionsbilogisch betrachtet von Natur aus Konkurrenten. Trotzdem kann man bei den Interaktionen zwischen Individuen einer Art, im allgemeinen auch als „Sozialverhalten“ bezeichnet, eine Vielzahl von Verhaltensweisen erkennen, die eindeutig koopertiv sind. Die ultimaten Ursachen solcher Verhaltensweisen sind z.B. die Fortpflanzung, die Brutpflege, die Fürsorge für die Jungtiere, der Schutz vor dem Gefressenwerden, der gemeinsame Beutefang oder die Sicherung von Weidegründen usw. Proximate Ursachen können in Erbkoordinationen oder in Lernvorgängen liegen.
Konkurrenz und Kooperation
Zu den Interaktionen zwischen Artgenossen gehören nicht nur kooperative Verhaltensweisen sondern auch Aggression und Konkurrenz, Rangordnung oder sogar Täuschung. Die Anpassungsselektion im Sinne Darwins ist, wenn auch nicht die einzige, so doch eine wichtige Grundlage der Evolution. Sie beruht auf dieser innerartlichen Konkurrenz und eventuell auf zwischenartlicher Kooperation. Die Individuen einer Art, die am meisten lebensfähige und überlebensfähige Nachkommen zeugen, geben damit ihre Gene und so auch viele ihrer Merkmale weiter. Der Kampf um einen Paarungspartner oder um eine Nahrungsressource ist häufig ritualisiert, d.h. für die Gegner besteht keine ernsthafte Verletzungsgefahr. Dies muss allerdings nicht so sein, wie man es z.B. von Kampfhähnen und Kampffischen weiß. Aber es ist einsehbar, dass bei Arten, bei denen die kämpfenden Rivalen sich verletzen , eine frühzeitige Beendigung des Kampfes die Fitness fördert, da sie auch den Sieger vor unnötigen Verletzungen schützt.
Unterschiedliches Balzverhalten ist eng gekoppelt mit unterschiedlichen Paarungssystemen. Während es bei vielen Tierarten keinerlei länger dauernde Paarbindungen gibt, kennt man andererseits monogame und polygame Beziehungen, wobei sowohl Polygynie als auch- seltener – Polyandrie vorkommen. Für die Paarungssysteme entscheidend dürften die besonderen Bedürfnisse der Jungen sein. So müssen Vögel nicht nur ihre Eier langwierig ausbrüten, die Jungen müssen dann auch mit erheblichen Nahrungsmengen gefüttert werden. Für beides ist eine Kooperation der Eltern von großem Vorteil. Deshalb ist eine monogame Paarbindung bei Vögeln häufig vorteilhaft – mindestens während der Brutzeiten und der Aufzucht der Jungen. Andererseits muss dies nicht unbedingt mit der rein monogamen Weitergabe der Gene, also mit der ausschließlichen Kopulation mit einem Geschlechtspartner, gekoppelt sein (vgl. Campell S. 1303, UB 185 Soziobiologie).
Häufig kommen in Tiersozietäten bestimmte Rangordnungen vor, die durch aggressive Auseinandersetzungen immer wieder gefestigt oder auch neu strukturiert werden. Für den reibungslosen Ablauf der innerartlichen Kooperation in einem Tierverband sind solche Rangordnungen u.U. von Vorteil, insbesondere wenn es um kompliziertes Zusammenarbeiten geht, wie etwa beim gemeinsamen Jagen. Bei Wölfen und anderen Hundeverwandten konnte nachgewiesen werden, dass die Rangordnung der weiblichen Tiere eines Rudels auch der Geburtenkontrolle dient: Wenn die Nahrung knapp ist, lassen die ranghöchsten Weibchen kaum Paarungen anderer, rangniedrigerer Weibchen zu. Sie sorgen damit dafür, dass nur ihre Gene weitergegeben werden. Ist reichlich Nahrung vorhanden, so lockern sie diese Restriktionen.
Schließlich ist das Revierverhalten ein wichtiger Bestandteil tierlichen Sozialverhaltens. Territorien oder Reviere dienen in der Regel der Sicherung der Nahrung, der Paarung und der Jungenaufzucht. Bei Vögeln werden solche Reviere häufig von Brutpaaren während der Brutzeit besetzt. Bei vielen Singvögeln müssen die Reviere relativ groß sein, weil sie auch der Nahrungsbeschaffung dienen. Bei Meeresvögeln können sie viel kleiner sein, da die Nahrung außerhalb des Reviers gesucht wird. Territorien werden häufig besonders markiert (Kot, Urin, Drüsensekrete). Auch akustische Markierungen wie lautes Brüllen der Seelöwen oder Gesänge der Singvögel dienen der Reviermarkierung. Territorialverhalten kann eine Population stabilisieren, da die Verteidigung des Territoriums verhindert, dass bei üppigem Nahrungsangebot eine Überpopulation entsteht, die dann u.U. wieder einen Zusammenbruch der Gesamtpopulation zur Folge hätte.
Altruismus
Altruismus oder uneigennützige Hilfeleistungen zwischen Individuen einer Art sind bei Tieren weit verbreitet. Besonders verbreitet sind Formen der Brutpflege, bei denen nur die Mütter, zum Teil Mütter und Väter und selten auch nur die Väter beteiligt sein können. Dabei geht es nicht nur darum, die Jungen zu füttern, zu wärmen und für ihr Wohlbefinden zu sorgen, sondern auch um die Verteidigung gegen Beutegreifer. Dies kann bis zur Aufoperfung des eigenen Lebens gehen. Die Soziobiologie versucht solche altruistischen Verhaltensweisen über die Fitness zu erklären. Bei der Brutpflege und bei der altruistischen Hilfe für Verwandte argumentiert die Soziobiologie mit dem Verwandtschaftskoeffizienten. Der Anteil der Gene, der bei zwei Individuen aufgrund gemeinsamer Abstammungen identisch ist. Der Verwandtschaftskoeffizient von Geschwistern beispielsweise beträgt 0,5, da 50 % der Gene von Geschwistern übereinstimmen. Für Cousins ersten Grades beträgt dieser Verwandtschaftskoeffizient 0,125. Es ist nach der soziobiologischen Theorie zu erwarten, dass sich Verwandte umso eher gegenseitig helfen, je höher dieser Koeffizient ist. Dies führt dann zu der sogenannten Familien- oder Verwandtschaftsselektion. (kin selection, Smith, Hamilton). Wenn man also sein Leben für zwei Kinder oder für acht Cousins opfert, so hat man genetisch bzw. evolutionsbiologisch gesehen, nichts verloren. Bei manchen altruistischen Verhaltensweisen ist eine Erklärung über den Verwandtschaftskoeffizienten allerdings nicht so eindeutig möglich. So warnen sich Murmeltiere gegenseitig durch Pfiffe vor Beutegreifern wie etwa Steinadlern. Wenn ein Adler oder ein anderer Fressfeind sich einer Murmeltierkolonie nähert, stößt eines der Murmeltiere einen schrillen Pfiff aus. Dadurch werden auch die anderen auf den Räuber aufmerksam und fliehen in ihre Baue. Das Pfeifverhalten allerdings wird für den Warner zu einem erhöhten Risiko. Nur wenn man davon ausgeht, dass die Murmeltiere einer Kolonie mehr oder weniger nahe verwandt sind, lässt sich dies ebenfalls über den Verwandtschaftskoeffizienten erklären. Eine andere Erklärungsmöglichkeit: Wenn alle Murmeltiere einer Kolonie zu diesem Verhalten bereit sind und es immer wieder ein anderes Tier trifft und dadurch der Nutzen und der Schaden ausgeglichen wird kann dieses Verhalten ebenfalls einen Fitnessgewinn bringen („Reziproker Altruismus“).
Tiergesellschaften
Die Vergesellschaftung von Individuen einer Art kann sehr unterschiedliche Organisationsmerkmale aufweisen. Unkoordinierte Verbände sind z.B. Schlafgemeinschaften, Überwinterungsgemeinschaften, Futtergemeinschaften. Ein gemeinsamer Ort und ein gemeinsames Ziel führen die Tiere zusammen. Man kennt solche Ansammlungen von vielen Insekten, aber auch bei Spinnentieren, Krebsen, Mollusken und bei allen Klassen der Wirbeltiere kommen sie vor. Solche Vergesellschaftungen sind in der Regel zeitlich begrenzt, die einzelnen Individuen können sich leicht wieder von der Gruppe lösen, und die Koordination zwischen den einzelnen Individuen ist gering. Schon etwas anders sieht es bei koordinierten Verbänden aus, wie sie etwa bei ziehenden Vogelschwärmen, wandernden Libellen, Heuschrecken und Schmetterlingen oder Fischschwärmen vorliegen. Hier findet oft eine erstaunliche Koordination der Flug- oder Schwimmbewegungen statt. Der soziale Gesichtspunkt ist deutlich, gemeinsamer Aufbruch zur Wanderung, gemeinsame Bestimmung des Zieles oder Lösung des Orientierungsproblemes. Gefahr von außen, etwa ein herabstürzender Raubvogel auf einen Starenschwarm, führt zu koordinierten Reaktionen. Der Schwarm kondensiert sich, bildet einen Stoßpulk, der gemeinsam zum Angriff übergehen kann. Anders reagiert ein Elritzenschwarm, bei dem ein Mitglied vom Hecht ergriffen wurde. Der ganze ergreift panikartig die Flucht, was damit zusammenhängt, dass von der Bißwunde der verletzten Elritze ein hochwirksamer Schreckstoff freigesetzt wird. Die so gewarnten Elritzen meiden den Ort, an dem ihr Genosse gefressen wurde, wochenlang. Hier handelt es sich also um ein soziales Warnsignal, das in Hautzellen gespeichert wird und dass ohne jeden biologischen Nutzen für das individuelle Leben ist, das aber für den Gesamtverband große Vorteile bringt.
Andere Schutzgemeinschaften finden sich z.B. bei verschiedenen Insekten. So können sich Feuerwanzen zu größeren Verteidigungsgemeinschaften zusammenschließen. Sie besitzen Verteidigungsdrüsen und damit verbunden eine Warnfärbung. Die Warnwirkung wird durch die Gruppierung erhöht.
Soziale Verbände höherer Organisation sind charakteristisch für die Insektenstaaten. Hier ist die soziale Bindung obligatorisch. Der Verband bildet eine geschlossene Gemeinschaft und es kommt zu einer Differenzierung der Individuen. Sämtliche Entwicklungsstadien von Eiern, Larven über Puppen bis zu den geschlechtsreifen Imagines sind Bestandteil dieses Verbandes. Alle Tätigkeiten, die für den Fortbestand für die Gemeinschaft wesentlich sind, werden im Kollektiv und arbeitsteilig ausgeführt. Häufig kommt es zu einer Kastenbildung, d.h. die ausgewachsenen Tiere haben – entsprechend ihren unterschiedlichen Aufgaben einen unterschiedlichen Körperbau. Typisch für das Funktionieren solcher Tierstaaten ist eine meist angeborene, sehr differenzierte Fähigkeit zur Kommunikation. Teilweise werden solche Staten als „Überorganismen“ bezeichnet.
Termiten z.B. sind besonders hoch organisierte staatenbildende Insekten mit mindestens drei Kasten: Königin und König als Geschlechtstiere leben immer zusammen, außerdem werden Arbeiter und Soldaten oft noch in verschiedenen Ausprägungen ausgebildet. Soldaten und Geschlechtstiere können sich nicht selbständig ernähren und sind auf die Fütterung durch die Arbeiter angewiesen. Insgesamt beruht das Zusammenspiel innerhalb des Termitenstaates auf komplizierter Kommunikation, teilweise auf der Basis von Pheromonen. Außerdem leben Termiten auch noch mit anderen Lebewesen in Symbiose. Als Pflanzenfresser können sie mit Hilfe von endosymbiontischen Bakterien und Einzellern Zellulose zersetzen. Andere Arten können sogar den Ligninstoff mit Hilfe von Pilzendosymbionten aufschließen. Außerdem werden von Termiten Pilzgärten angelegt, und zwar auf einem Gemisch aus Kot und zerkauter Nahrung und Holz. Die Pilzgeflechte dienen vor allem den Larven als Nahrung.
Die Zusammenarbeit im Termitenstaat sorgt für gleichbleibende Innentemperaturen, günstige Feuchtigkeitsbedingungen und sichere Aufzucht der Nachkommen (vgl. UB 169, S. 45).
Im Prinzip ähnlich, aber meist nicht ganz so kompliziert, sind die Verhältnisse bei Ameisen und bei anderen Hautflüglern. Bemerkenswert ist die besonders komplizierte Form der Kommunikation der Honigbienen (vgl. Hedewig 2000 in UB 260).
Symbiose in Ökosystemen
Für das Wirkungsgefüge eines Ökosystems bilden symbiotische Beziehungen eine entscheidende Rolle, obwohl sie bisher in der ökologischen Literatur noch relativ wenig berücksichtigt wurden. Ganz allgemein kann man sagen, dass Ökosysteme dazu tendieren, im Laufe ihrer Entwicklung an Komplexität zuzunehmen. So sind die ältesten Ökosysteme gleichzeitig die komplexesten und die Wechselbeziehungen solcher Systeme sind besonders kompliziert. Hier soll etwas ausführlicher auf die Bedeutung der Symbiosen für den Stoffkreislauf in Ökosystemen eingegangen werden. Da die Chloroplasten aller Höheren Pflanzen und Algen aus endosymbiontischen Prokaryoten hervorgegangen sind, wird der größte Teil der Primärproduktion in der Biosphäre durch eine Symbiose geleistet. Abgesehen davon spielen Flechten als Primärproduzenten auf etwa einem Achtel der Landfläche (1,2 x 107 km2) eine entscheidende Rolle. Bedeutend ist weiterhin der Beitrag der Korallenriffe zur Primärproduktion.
Die enge Partnerschaft von Pilzen und Landpflanzen besteht vermutlich seit der Eroberung des Landes im ausgehenden Silur. Für Primärproduktion und Stoffkreislauf in der Biosphäre ist diese Symbiose von Höheren Pflanzen und Pilzen (Mykorrhiza) besonders wichtig. Man nimmt an, dass Mykorrhizapilze 10 bis 20% der fotosynthetischen Primärproduktion von Pflanzen aufnehmen, das sind bis zu 2 x1013 kg pro Jahr. Besondere Bedeutung haben Mykorrhiza-Pilze für de Phosphor- und Stickstoff-Kreislauf in Ökosystemen . (vgl. Agerer, UB ), Sie stellen eine Kurzschluss artige Verbindung zwischen organischen Abfallstoffen und Primärproduzenten her. Dadurch kann der Export dieser Elemente aus Ökosystemen deutlich verringert werden. Wie Perakis und Hedin (2002, S. 416-418) nachweisen konnten, ist der Austrag an anorganischem Stickstoff in naturnahen, vom Menschen wenig beeinflussten Regenwäldern des gemäßigten Südamerika viel geringer als in entsprechenden, stark vom Menschen beeinflussten Wäldern Nordamerikas (Abb. ) . Dies könnte darauf hindeuten, dass es in diesen Wäldern kaum zu einer totalen Remineralisierung von Stickstoffverbindungen kommt. Ähnliches dürfte für Phosphorverbindungen gelten.
Die Verbreitung von Mykorrhizapilzen ist viel größer, als man dies ursprünglich angenommen hatte. So gilt als sicher, dass in tropischen Wäldern etwa 90 % aller Gehölze Mykorrhizen ausbilden. Da viele Pilze mit mehreren Baumarten Partnerschaften eingehen, ist nicht nur ein Stofftransport von einem Baum zum anderen sondern auch von einer Baumart zur anderen möglich. Besonders spektakulär ist in diesem Zusammenhang, dass durch Pilzwurzeln vermittelt auch Pflanzen existieren können, die kein Chlorophyll mehr bilden und dann als reine Parasiten auf den Pilzen leben. So findet man das bleiche Wintergrüngewächs Fichtenspargel unter Fichten und Buchen. Vermittelt durch einen Mykorrhizapilz lebt der Fichtenspargel von der Primärproduktion der Buchen bzw. Fichten.
Schließlich können Pilze auch tierische Eiweißquellen für Höhere Pflanzen erschließen, die sonst nur den Extremspezialisten – den sogenannten Carnivoren oder Insektivoren – vorbehalten bleiben. So konnte nachgewiesen werden, dass Laccaria bicolor (Zweifarbiger Lacktrichterling) Springschwänze (z.B. der Art Folsomia candida) „fressen“ kann. Der Pilz immobilisiert die Springschwänze zunächst. Dann dringt das Mycel in deren Körper ein und fängt an, sie zu „verdauen“. Da Laccaria gleichzeitig mit Waldbäumen eine Mykorrhiza eingeht, werden tierliche Stickstoffverbindungen über den Pilz an die Bäume weitergegeben. Durch 15N-Isotopenmarkierung konnte nachgewiesen werden, dass bis zu 25 Prozent des pflanzlichen Stickstoffs aus Springschwänzen stammen, die von Laccaria gefressen wurden. Als Gegenleistung versorgt der Baum den Pilzpartner mit Kohlenhydraten, auch mit solchen, die dann zu proteolytischen Enzymen umgebaut werden können (Klironomos, Hart 2001,p.651,652).
Untersuchungen an isolierten Rasenstücken ergaben, dass durch den von Mykorrhizapilzen vermittelten Stoffaustausch die Konkurrenz zwischen den Pflanzenarten vermindert wird. Dies führt dazu, dass die Zugangsmöglichkeiten zu Mineralstoffen ausgeglichen werden und dass die Koexistenz verschiedener Arten leichter ist. Eine Zunahme der Artenvielfalt ist die Folge (A.E. Douglas Symbiotic interactions 1994).
Auch im Zusammenhang mit Primärsukzessionen (Neubesiedelung von vorher vegetations- bzw. organismenfreien Substraten etwa nach Vulkanausbrüchen oder beim Gletscherrückzug) können Symbiosen eine wichtige Rolle spielen. Dies gilt etwa für die Neubesiedelung von Gletschern freigegebener Felsflächen durch Flechten und anschließend durch Pflanzen, die in Symbiose mit Luftsticksoff – fixierenden Bakterien leben. Genauere Untersuchungen in Glacer Bay/ Alaska, wo ein Gletscher sich in überlieferten Zeiträumen um etwa 100 km zurückgezogen hat, zeigt eine ständige Zunahme von Stickstoff in den Böden. Als Erstbesiedler an Höheren Pflanzen spielt die Silberwurz (Dryas) eine entscheidende Rolle. Sie enthält stickstofffixierende Bakterien der Gattung Frankia. In der Folgezeit besiedeln Erlen, Weiden und Pappeln die Gletscherrückzugsgebiete. Die endosymbiontischen Actinomyceten der Gattung Frankia können in Erlenbeständen bis zu 180 kg Stickstoff/ ha und Jahr fixieren (Abb. Grafik zur Stickstoffzunahme in Gletscherböden von Glacer Bay). In bestimmten limnischen Lebensräumen, z.B. in ostasiatischen Reisfeldern, dürfte die Stickstofffixierung durch mit dem Schwimmfarn Azolla zusammenlebenden Blaugrünen Bakterien der Gattung Anabena eine wichtige Rolle spielen (50 bis 150 kg Stickstoff/ ha und Jahr). In tropisch-subtropischen marinen Lebensräumen des pazifischen Raumes spielt die Diatomee Rhizosolenia mit endosymbiontischen Blaugrünen Bakterien eine ähnlich bedeutende Rolle beim Zugang des Ökosystems zur Luftstickstoffquelle.
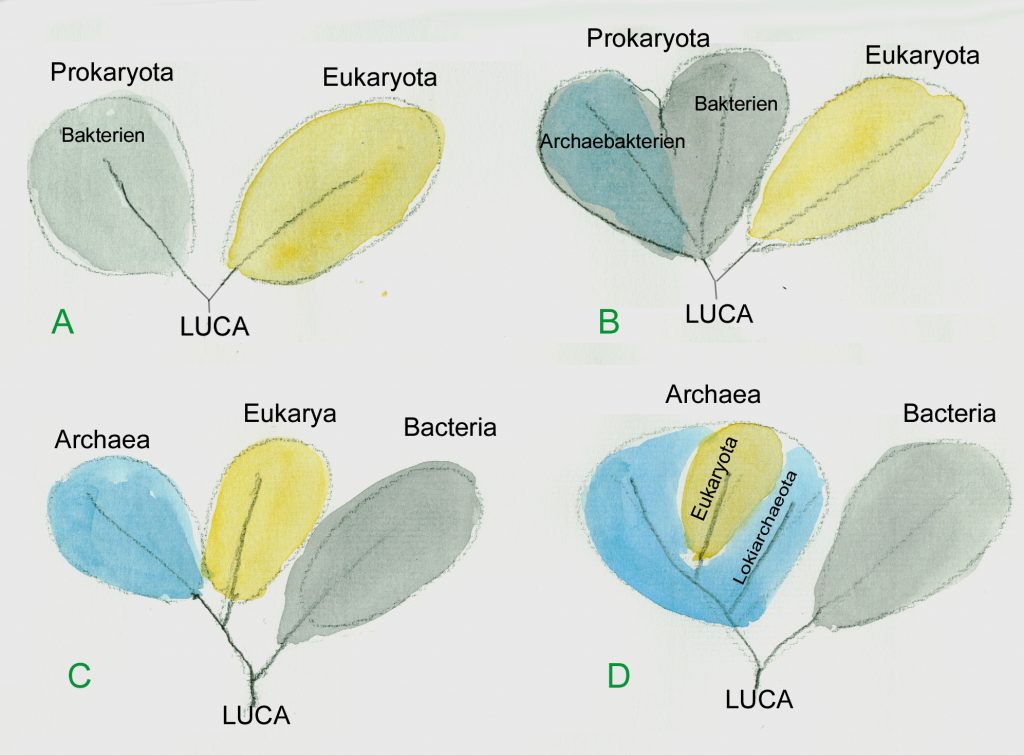
Erst in jüngster Zeit beginnt man, die komplizierten Wechselwirkungen zu studieren, die zwischen den Mikroorganismen und dem höheren Leben der Ozeane bestehen. Die Bedeutung der Prokaryoten und insbesondere der ursprünglichen „Domäne“ der Archaea ist mengen- und massenmäßig in den Ozeanen viel bedeutender als lange Zeit angenommen. So ist reiches Archaea-Vorkommenie keineswegs auf die Umgebung der schwefelspuckenden Tiefseeschlote begrenzt. Vielmehr dürften sie 40 % der Tiefseeorganismen insgesamt ausmachen und die Tiefsee ist bei weitem der größte Lebensraum der Erde. Aber auch in oberflächennahen Wasserschichten der Ozeane spielen Archaebakterien eine große Rolle. Die zur Fotosynthese fähigen a-Proteobacteria machen vemutlich wenigstens 10 % aller Bakterien in den Ozeanen aus (Copley 2002) und sie sind damit für ca. 5 % der Fotosynthese bedingten Primärproduktion verantwortlich. Dabei läuft ihre Fotosynthese allerdings etwas anders ab. Sie produzieren nämlich keinen Sauerstoff, sondern verwerten den bei der Fotosynthese freigesetzten Sauerstoff sofort wieder für eigene Synthesen. Außerdem nutzen sie Lichtenergie, um organische Verbindungen abzubauen (Fotoheterotrophie). Diese Fähigkeit, von der man bis vor kurzem nichts wusste, hat bedeutende Auswirkungen für den Kohlenstoffkreislauf und die mögliche Bedeutung der Ozeane als Kohlenstoffsenke. Ein großer Teil des Kohlenstoffdioxids, das in den Ozeanen durch die Fotosynthese fixiert wird, bleibt – wenn die Planktonorganismen absterben – in gelöstem oder suspendiertem organischem Material zurück. Dieses organische Material dürfte in größerer Menge als bisher angenommen von Proteobakterien genutzt werden. So tragen diese Prokaryoten dazu bei, dass der Kohlenstoff stärker als bisher angenommen in den oberen Wasserschichten bleibt – eine schlechte Nachricht für diejenigen, die bisher hofften, dass übermäßiger Anstieg des Kohlenstoffdioxidgehaltes der Atmosphäre durch die Ozeane ausgeglichen werden kann. Wie neue Arbeiten zeigen, gibt es noch eine große Zahl anderer Prokaryoten mit außergewöhnlichen Stoffwechsel- und Fotosynthesewegen, die bisher noch nicht erforscht sind und die eine Vielzahl neuer Beziehungen und Stoffflussschleifen erwarten lassen, die das Zusammenspiel in dem von Planktonorganismen bestimmten Ökosystem der freien Ozeane viel komplizierter erscheinen lassen wird, als dies bisher angenommen wurde. So dürfte die von Halobakterien als Fotergie bekannte Erscheinung, bei der Sonnenlicht über Rhodopsin und verwandte Pigmente als Energiequelle für eine Membran-Protonenpumpe genutzt wird, in oberflächennahen marinen Habitaten weit verbreitet sein. Auch die Bedeutung Stickstoff-(N2)-fixierender Prokaryoten in marinen Ökosystemen ist vermutlich unterschätzt worden. So dürfte insbesondere die Zahl der entocytosymbiotischen Stickstofffixierer in den einzelligen Planktonalgen eine viel größere Rolle spielen als bisher angenommen (Zehr 1998). Auch Viren sind häufig in marinen Ökosystemen. Sie können bei Algenblüten regulierend wirken. Wenn die virusbefallenen Zellen solcher großen Algenblütengebiete plötzlich sterben, setzen sie eine große Menge organischer Materie frei. Auf diese Art und Weise können Viren möglicherweise zur plötzlichen massenhaften Freisetzung von Dimethylsulfid (DMS) beitragen. Wie zum ersten Mal von Lovelock nachgewiesen, fördert DMS in der Atmosphäre die Wolkenbildung und erhöht damit die Menge der an der Atmosphäre reflektierten Sonnenstrahlen. Dies kann eine deutliche Abkühlung des Erdklimas bedeuten. Es ist durchaus naheliegend, anzunehmen, dass die große Stabilität der Biosphäre solchen mikrobiellen Wechselwirkungen zu verdanken ist. Im Kleinen kennt man solche eng kooperierende Mikrobensysteme, in denen sich die einzelnen Bestandteile gegenseitig stabilisieren, z.B. von denen von Kefir oder Kombucha.
Eine besondere Form der Wechselwirkung ist der durch Viren vermittelte horizontale Gentransfer. Auch diese Form der Wechselwirkung wurde vermutlich in der Vergangenheit eher unterschätzt.
Menschliche Macht, Mitgefühl und Zukunftsfähigkeit
Je höher entwickelt das Nervensystem und das Lern- und Erinnerungsvermögen einer Tierart, desto flexibler und anpassungsfähig kann auch das Sozialverhalten werden. Junge werden „geprägt“, Kinder lernen von ihren Eltern, schließlich können sich sogar Traditionen herausbilden. An der Spitze dieser Entwicklung stehen zweifellos die Primaten und schließlich die Menschen.
Sicherlich wirkt sich dies auch auf das Kooperationsverhalten aus. So konnte durch Computersimulationen nachgewiesen werden, dass kooperatives Verhalten den kooperierenden Individuen Selektionsvorteile bringt, wenn die Individuen innerhalb einer Population erkennen können, ob andere Individuen kooperationsbereit sind oder nicht. Dies setzt ein hochdifferenziertes Wahrnehmungsvermögen voraus. (Sigmund, Nowak 2001, 403,404).
Auch die sogenannte Altruistische Bestrafung (Altruistic punishment, Fehr, Gächter, 2002, 137-140) stellt eine Verhaltensweise dar, die Altruismus fördert: Sie beschreibt ein typisch menschliches Verhalten gegenüber Individuen, die agressiv ihre eigenen Interessen verfolgen. Solche Individuen werden bestraft, auch wenn der Strafende davon keinen direkten eigenen Vorteil hat. Diese Verhaltensweise setzt voraus, dass man sich relativ gut in andere Individuen hineinversetzen kann – eine Fähigkeit die Menschen in höherem Maße haben als andere Arten.
Wahrnehmungsfähigkeit und Gehirn gestatten es den Menschen, sich ein Bild ihrer Umwelt zu machen, das planvolles und gezieltes Handeln erlaubt. Die abstrakte Sprache macht es möglich, sich intensiv und detailliert mit anderen Menschen auszutauschen, Erkenntnisse, Einsichten, Erfahrungen und Ideen weiterzugeben. Die Schrift und seit Kurzem die elektronischen Medien erlauben eine Konservierung von Information und in Zukunft vielleicht auch eine enge Kooperation von Gehirnen und Systemen der elektronischen Datenverarbeitung. So wird von manchen Informatikern eine Symbiose zwischen menschlichem Gehirn und Maschine angedacht: „Schließlich werden wir darangehen die externen Hilfsmodule mit dem Gehirn zu verbinden – beispielsweise durch Millionen mikroskopischer Elektroden; man könnte sie in das große Faserbündel namens Corpus callosum implantieren, das als gewaltiger Datenbus die beiden Gehirnhälften miteinander verbindet.“ (Minsky 1994).
Mit Hilfe seines Gehirns kann der Mensch Szenarien in Gedanken durchspielen, die Folgen bestimmter Handlungen vorhersehen. Dadurch, dass Beziehungen und Wechselwirkungen in die Zukunft projiziert werden, kann man ihre Folgen abschätzen. Diese Modellbildungsfähigkeiten sind ein enormer Machtfaktor. Menschen neigen allerdings dazu, diese Macht zu überschätzen und damit gleichzeitig die Verantwortung zu unterschätzen, die aus der Erkenntnisfähigkeit erwächst. Denn die Modelle, die eben doch nur Modelle und damit unvollkommene Bilder der Wirklichkeit sind, werden oft als ganz real genommen und man verlässt sich voll auf ihre Aussagen. So werden mit der Zunahme menschlicher Macht und Manipulationsmöglichkeiten die als Folgen menschlicher Eingriffe auftretenden Katastrophen immer größer und gefährlicher.
Vielleicht hilft ein Nebeneffekt unseres Weltbildapparates dabei, das richtige Maß zu finden: Er gestattet es den Menschen nämlich auch, sich in andere Individuen hineinzuversetzen, die Welt „mit ihren Augen“ zu sehen. Diese Fähigkeit ist Voraussetzung für Mitgefühl, Mitleid und die Möglichkeit, sich mit Anderen zusammen zu freuen und damit die Voraussetzung für Wertempfinden, Ethik und Moral.
Dabei betrifft Mitfühlen und Mitleiden nicht nur Mitglieder der eigenen Art, sondern auch andere Mitgeschöpfe. In ihrem Versuch „Leben“ zu beschreiben und verständlich zu machen weisen Lynn Margulis und Dorian Sagan besonders auf dieses menschliche Bewusstsein hin, das im Grunde ein Bewusstsein der Biosphäre oder des gesamten Lebens der Erde darstellt, da es allmählich mit der Evolution gewachsen ist. „In diesem Sinne ist das intuitive Wissen und Werden, nach dem jedes Einzelbewusstsein eine Illusion ist und wir alle einem einzigen Urgrund, nämlich Brahman angehören, vielleicht völlig richtig: Nicht nur unsere chemische Zusammensetzung ist ein gemeinsames Erbe, sondern auch unser Bewusstsein und die Notwendigkeit in einem Kosmos zu überleben, der aus der gleichen Materie besteht wie wir, der aber unserem Leben und unseren Belangen gleichgültig gegenübersteht.“ (Margulis, Sagan 1997).
Literatur
Agerer, R.: Mykorrhiza. UB 183/17:49-51, 1993
Ahmadjian, V., Paracer, S.: Symbiosis: An introduction to biological associations. Univ.Press New England, Hanover (USA) 1986
Barlow, C. (Hrsg.): Evolution extended. Biological debates on the meening of life. MIT Cambridge (USA), London, 1994
Berdoy,M, Webster, J.P., Macdonald, D.W.: Fatal attraction in rats infected with Toxoplasma gondii: Proceedings of the Royal Society of London B267:1591-1594, 2000
De Bary, A.: Die Erscheinung der Symbiose. Vortrag gehalten auf der Versammlung Deutscher Naturforscher und Ärzte zu Cassel. Trübner, Strasburg 1879
Copley, J: All at sea. Nature 415, 7.2.2002: 572-574
Diamond, J.: Guns, Germs and Steel. Norton, London, New York 1997
Douglas, A.E.: Symbiotic interactions. Oxford Univ. Press, Oxford, New York… 1994
Campbell, N.A.: Biologie, Spektrum, Heidelberg, Berlin, Oxford 1997
Fehr, E., Gächter, S.: Alturistik punishment in humans. Nature 415, 10.1.2002: 137-140
Keeble, F.: Plant animals. A study in symbiosis. Cambridge Univ.Press, Cambridge 1910
Keeling, P.J.: Parasits go to the free monty. Nature 414, 22.11.2001: 401/ 402
Klironomus, J.N., Hart, M.M.: Animal nitrogene sweap für plant carbon. Nature 410. 5.4.2001: 651/ 652
Krombein, K. V. et al.:Biodiversity of domatia occupants (ants, wasps, bees and others) of the Sri Lankan myrmecophyte Humboldtia laurifolia VAHL (Fabaceae).Smithonian Contributions to Zoology 603, Washington (USA) 1999
Kropotkin, P.: Gegenseitige Hilfe in der Tier- und Menschenwelt. Trotzdem-Verlag, Glasenau 19932 (Übersetzung der englischen Originalausgabe von 1902: Mutual aid)
Margaris, N.S., Arianoustou-Faraggitaki, M., Oechel, W.C. (Hrsg.): Beeing alive on land. Junk Publishers, The Hague, Boston, Lancaster 1984
Margulis, L. (Hrsg.): Symbiosis in cell evolution 1981; 2nd ed.: Endosymbiosis in cell evolution. Freeman, San Fransisco (USA) 1993
Margulis, L., Fester, R. (Hrsg.): Symbiosis as a source of evolutionary innovation: Speciation and morphogenisis. MIT Cambridge(USA) 1989
Margulis, L., Sagan, D.: Leben. Vom Ursprung zur Vielfalt. Spektrum, Heidelberg, Berlin 1999
Masuch, G.: Biologie der Flechten. Quelle & Meyer, Heidelberg, Wiesbaden 1993
Martin, K.: Ökologie der Biozönosen. Springer, Berlin, Heidelberg, New York 2002
Max-Planck-Gesellschaft, Presseinformation: Blattnektar – pflanzliche „Heuer“ für Schutzinsekten, 2001 http://www.mpg.de/pri01/pri0108.htm
McCarthy, H.O., Fitzpatrick, S., Irwin, S. W. B.: A transmissible trematode affects the direction and rhythm of movement in a marine gastropode. Animal Behavior, London 59: 1161-1166, 2000
Minsky, M.: Werden Roboter die Erde beherrschen? In: Spektrum der Wissenschaften, Spezial 3: Leben und Kosmos, S.80-87, Heidelberg 1994
Perakis, S.S., Hedin, L.O.: Fluxes and ftes of nitrogen in soil of an unpolluted old-growth temperate forest, southern Chile. Ecology 82(8):2245-2260, 2001
Probst, W. (Hrsg.) :Algen. UB 225/21, 1997
Probst, W. (Hrsg.) Pflanzen und Insekten. UB 236/22, 1998
Probst, W. (Hrsg.): Riffe. UB 254/24, 2000
Puff, C.: Flora der Pläotropen: Schwerpunkt SEA: (Südostasiatische) Ameisen- und Kannenpflanzen, 2002 http://mailbox.univie.ac.at/Cristian.Puff/AS_ Ameisen&Kann.htm
Queller, D.C.: Pax argentinica. Nature 405, 1.6.2000: 519/520
Reisser, W.: Algae in symbiosis: Plants, animals, fungi, viruses. Interactions explored. Inter Press, Bristol 1992
Sapp, J.: Evolution by association. The history of symbiosis. Oxford University Press, Oxford 1994
Sauer-Sachtleben, M.: Kooperation mit der Evolution. Das kreative Zusammenspiel von Mensch und Kosmos. Dietrichs, München 1999
Schwemmler, W., Schenk, H. E. A. (Hrsg.):Endocytobiology, Vol 1: Endosymbiosis and cell biology. Walter de Gruyter, Berlin 1980
Shigenobu, S. et al.: Genome sequence of the endocellular bacterial symbiont of aphids Buchnera sp. APS. Nature 407, 7.9.2000: 81-86
Sigmund, K., Nowak, M.A.: Tides of tolerance. Nature 414, 22.11.2001: 403/404
Sommer, U.: Competition and coexistens. Nature 402, 25.11.1999: 366/367
Von Dohlen et al.: Mealybug ß-proteobacterial endosymbionts contain Y-proteobacterial symbionts .Nature 412, 26.6.2001: 433-436
Von Lüpke, G.: Kooperation als Motor des Lebens. Natur und Kosmos, Dez.1999: 11-14
Whitfield, J.: Eat me! Nature 406, 24.8.2000: 840
Wilson, E. O.: The social conquest of earth. Liveright, New York 2012